Até 4.000 A.C. temos a pré-História e, com a escrita, inicia-se a história, dividida nas idades antiga, média, moderna e contemporânea.
A idade média, ou idade medieval, que precedeu a idade moderna, compreendeu o período que se estende de 476, com a queda do Império Romano, até o ano 1453 com a tomada de Constantinopla pelo império turco otomano. O período foi marcado pela hegemonia da Igreja Católica, enfraquecimento comercial, sistema de produção feudal e sociedade hierarquizada.
São alguns dos mais importantes matemáticos, físicos e outros estudiosos que precederam à Revolução Científica: Leonardo da Vinci (Itália, 1452-1519), Nicolau Copérnico (Polônia, 1473-1543), Paracelso (Suíça, 1493-1541) e Andreas Libavius (Alemanha, 1555-1616).
A Revolução Científica proporcionou a realização de importantes estudos na matemática, física, química, geografia, astronomia, como as Leis de Newton, que explicaram perfeitamente diversos aspectos físicos e matemáticos, e são universais, insubstituíveis, permanentemente válidos, e utilizados no desenvolvimento de diversos outros estudos importantes ao longo dos séculos que se seguiram ao criador.
O Iluminismo foi um movimento intelectual que se desenvolveu na Europa a partir do século XVII (em torno de de 1620) - mas que teve seu apogeu a partir de 1715, até a Revolução Francesa em 1789.
Na química, a edição do primeiro livro sobre química por Libavius, em 1597, precedeu a transição para Revolução Científica, ainda um século até Dalton formular sua teoria atômica.
Alguns dos cientistas mais importantes desse período da Revolução Científica foram Galileu Galilei (Itália, 1564-1642), Jan Baptist Van Helmont (Bélgica, 1579-1644), Renê Descartes (França, 1596-1650), Robert Boyle (Inglaterra, 1627-1691), Isaac Newton (Inglaterra, 1643-1727), Georg Ernst Stahl (Alemanha, 1659-1734), Joseph Louis Lagrange (Itália, 1736-1813), Pierre-Simon, Marquês de Laplace (França, 1749- 1827), Antoine Lavoisier (França, 1743-1794), John Dalton (Inglaterra, 1766- 1844), William Rowan Hamilton (Irlanda, 1805-1865) e Dimitri Mendeleev (Rússia, 1834-1907).
Surgimento da química médica (Século XVII)
Nessa época, os químicos, liderados pelo suíço-alemão Paracelso, abandonaram as duas metas alquimistas e passaram a descobrir substâncias que curavam doenças (remédios). No final do século XVIII, durante a Revolução Francesa, a Química, a exemplo da Física, torna-se uma ciência exata.
O químico Lavoisier descobriu que, durante as transformações químicas e físicas, ocorre a conservação da matéria (Lei da Conservação da matéria). Foi com Lavoisier que se iniciou, na Química, o método científico, que estuda os porquês e as causas dos fenômenos.
Nascimento do primeiro químico brasileiro (1750). Considerado um Químico autodidata e desconhecido na história, uma vez que jamais saiu do Brasil, João Manso Pereira fabricou muitas peças cerâmicas, aguardente semelhante ao rum cubano, vinho de açúcar e extraiu álcalis da bananeira.
Tratado elementar de química por Lavoisier (1789)
Este movimento promoveu mudanças políticas, econômicas e sociais, baseadas nos ideais de liberdade, igualdade e fraternidade. Tinha o apoio da burguesia, pois os pensadores e os burgueses tinham interesses comuns.
As críticas do iluminismo ao antigo regime eram em vários aspectos como mercantilismo, absolutismo monárquico e o poder da igreja e as verdades reveladas pela fé, defendendo a liberdade econômica sem a intervenção do estado na economia, o antropocentrismo, com o avanço da ciência e da razão e o predomínio da burguesia e seus ideais.
As ideias liberais do Iluminismo se disseminaram rapidamente pela população. Alguns reis absolutistas, com medo de perder o governo - ou mesmo a cabeça -, passaram a aceitar algumas ideias iluministas.
Estes reis eram denominados Déspotas Esclarecido pois tentavam conciliar o jeito de governar absolutista com as ideias de progresso iluministas.
Alguns representantes do despotismo esclarecido foram: Frederico II, da Prússia; Catarina II, da Rússia; e Marquês de Pombal, de Portugal.
Alguns pensadores ficaram famosos e tiveram destaque por suas obras e ideias neste período. São eles:
John Locke
John Locke é Considerado o “pai do Iluminismo”. Sua principal obra foi “Ensaio sobre o entendimento humano”, aonde Locke defende a razão afirmando que a nossa mente é como uma tábula rasa sem nenhuma ideia.
Defendeu a liberdade dos cidadãos e Condenou o absolutismo.
Voltaire
François Marie Arouet Voltaire destacou-se pelas críticas feitas ao clero católico, à inflexibilidade religiosa e à prepotência dos poderosos.
Montesquieu
Charles de Secondat Montesquieu em sua obra “O espírito das leis” defendeu a tripartição de poderes: Legislativo, Executivo e Judiciário.
No entanto, Montesquieu não era a favor de um governo burguês. Sua simpatia política inclinava-se para uma monarquia moderada.
Rousseau
Jean-Jacques Rousseau é autor da obra “O contrato social”, na qual afirma que o soberano deveria dirigir o Estado conforme a vontade do povo. Apenas um Estado com bases democráticas teria condições de oferecer igualdade jurídica a todos os cidadãos. Rousseau destacou-se também como defensor da pequena burguesia.
Quesnay
François Quesnay foi o representante oficial da fisiocracia. Os fisiocratas pregavam um capitalismo agrário sem a interferência do Estado.
Adam Smith
Adam Smith foi o principal representante de um conjunto de ideias denominado liberalismo econômico, o qual é composto pelo seguinte:
- o Estado é legitimamente poderoso se for rico;
- para enriquecer, o Estado necessita expandir as atividades econômicas capitalistas;
Revolução Francesa (em francês: Révolution française, 1789-1799) foi um período de intensa agitação política e social na França, que teve um impacto duradouro na história do país e, mais amplamente, em todo o continente europeu. A monarquia absolutista que tinha governado a nação durante séculos entrou em colapso em apenas três anos. A sociedade francesa passou por uma transformação épica, quando privilégios feudais, aristocráticos e religiosos evaporaram-se sobre um ataque sustentado de grupos políticos radicais, das massas nas ruas e de camponeses na região rural do país.[1] Antigos ideais da tradição e da hierarquia de monarcas, aristocratas e da Igreja Católica foram abruptamente derrubados pelos novos princípios de Liberté, Égalité, Fraternité (em português: liberdade, igualdade e fraternidade). As casas reais da Europa ficaram aterrorizadas com a revolução e iniciaram um movimento contrário que, até 1814, tinha restaurado a antiga monarquia, mas muitas reformas importantes tornaram-se permanentes. O mesmo aconteceu com os antagonismos entre os partidários e inimigos da revolução, que lutaram politicamente ao longo dos próximos dois séculos.
Em meio a uma crise fiscal, o povo francês estava cada vez mais irritado com a incompetência do rei Luís XVI e com a indiferença contínua e a decadência da aristocracia do país. Esse ressentimento, aliado aos cada vez mais populares ideais iluministas, alimentaram sentimentos radicais e a revolução começou em 1789, com a convocação dos Estados Gerais em maio. O primeiro ano da revolução foi marcado pela proclamação, por membros do Terceiro Estado, do Juramento do Jogo da Péla em junho, pela Tomada da Bastilha em julho, pela aprovação da Declaração dos Direitos do Homem e do Cidadão em agosto e por uma épica marcha sobre Versalhes, que obrigou a corte real a voltar para Paris em outubro. Os anos seguintes foram dominados por lutas entre várias assembleias liberais e de direita feitas por apoiantes da monarquia no sentido de travar grandes reformas no país.
A Primeira República Francesa foi proclamada em setembro de 1792 e o rei Luís XVI foi executado no ano seguinte. As ameaças externas moldaram o curso da revolução. As guerras revolucionárias francesas começaram em 1792 e, finalmente, apresentaram espetaculares vitórias que facilitaram a conquista da Península Itálica, dos Países Baixos e da maioria dos territórios a oeste do Reno pela França, feitos que os governos franceses anteriores nunca conseguiram realizar ao longo de séculos. Internamente, os sentimentos populares radicalizaram a revolução significativamente, culminando com a ascensão de Maximilien Robespierre, dos jacobinos e de uma ditadura virtual imposta pelo Comitê de Salvação Pública, que estabeleceu o chamado Reino de Terror entre 1793 e 1794, período no qual entre 16 mil e 40 mil pessoas foram mortas.[2] Após a queda dos jacobinos e a execução de Robespierre, o Diretório assumiu o controle do Estado francês em 1795 e manteve o poder até 1799, quando foi substituído pelo Consulado, sob o comando de Napoleão Bonaparte.
A era moderna tem-se desdobrado na sombra dos ideais conquistados pela Revolução Francesa. O crescimento das repúblicas e das democracias liberais ao redor do mundo, a difusão do secularismo, o desenvolvimento das ideologias modernas e a invenção da guerra total[3] tiveram o seu nascimento durante a revolução. Eventos subsequentes que podem ser rastreados com a revolução incluem as Guerras Napoleônicas, duas restaurações separadas da monarquia (a primeira em 1814 e a segunda, a Restauração Bourbon, em 1815), e duas revoluções adicionais (1830 e 1848) ajudaram a moldar a França moderna.
A Revolução Francesa foi um dos acontecimentos mais importantes da história contemporânea do Ocidente. Ela marcou o fim da Idade Moderna e o início da Idade Contemporânea, de acordo com o que foi estipulado por historiadores europeus. O motivo para isso foram as influências da Revolução Francesa no mundo.
A Revolução Francesa marcou a ascensão da burguesia como classe social dominante, superando a aristocracia proprietária de terras, bem como a criação de novas instituições e novas formas de organizar a vida econômica, política e social que iriam se expandir para todo o planeta.
Com a Revolução Francesa, o capitalismo rompeu os obstáculos políticos feudais que ainda vigoravam na Europa Ocidental, juntando-se às transformações econômicas desencadeadas com a Revolução Industrial.
Essas mudanças vinham sendo preparadas desde os séculos XVII e XVIII, com o desenvolvimento do pensamento racional Iluminista. Para os iluministas, a razão poderia auxiliar todos os homens na explicação dos fenômenos da natureza e da forma de organização da sociedade.
Não que os iluministas fossem essencialmente revolucionários. Mas as ideias iluministas serviram, junto à utilização da razão para interpretar o mundo, para os revolucionários franceses questionaram o caráter sagrado do poder, defendido pelos reis, pela aristocracia e pela Igreja.
Todos os homens poderiam exercer o poder. Mas para isso era necessário criar instituições que garantissem esse exercício. Nesse sentido, a República foi a principal dessas instituições. Ela representava o fim dos privilégios da aristocracia e a libertação dos camponeses dos laços de servidão que os prendiam à nobreza e ao clero. Nas cidades, tinham fim as corporações feudais que limitavam os negócios da burguesia.
Mas mesmo antes da Revolução Francesa, os ideais iluministas já haviam possibilitado que na América do Norte os colonos ingleses realizassem a Independência dos EUA e construíssem também uma República. Mas o impulso maior foi mesmo dado pela Revolução Francesa, graças ao poderio do Estado francês.
A Revolução Francesa influenciou ainda outros processos de independência no continente americano. Em 1794, os africanos escravizados que trabalhavam nas lavouras de cana-de-açúcar do Haiti conseguiram o fim da escravidão após uma sanguinária guerra de independência. Era o primeiro país do continente a por fim à escravidão. No Brasil, a Conjuração Baiana (ou Revolta dos Alfaiates) de 1798 também foi fortemente influenciada pelos acontecimentos da Revolução Francesa.
O historiador Eric. J. Hobsbawm afirma ainda que os revolucionários franceses influenciaram simbolicamente as nações emergentes da Europa do século XIX com as bandeiras tricolores.
O conceito e o vocabulário do nacionalismo, desenvolvido com educação universal, e o recrutamento de cidadãos de todas as classes para o exército foram mais umas das influências da Revolução Francesa.
O modelo de organização técnica e científica, além do sistema métrico de medidas (metro, centímetro, decímetro etc.), foi outra contribuição desenvolvida nesse período.
a
- para expandir as atividades capitalistas, o Estado deve dar liberdade econômica e política para os grupos particulares.
A principal obra de Smith foi “A riqueza das nações”, na qual ele defende que a economia deveria ser conduzida pelo livre jogo da oferta e da procura.
tratado
1452-1519, Leonardo da Vinci, Itália. Polímata, foi uma das figuras mais importantes do Alto Renascimento, que se destacou como cientista, matemático, engenheiro, inventor, anatomista, pintor, escultor, arquiteto, botânico, poeta e músico. É ainda conhecido como o percursor da aviação e da balística. Leonardo frequentemente foi descrito como o arquétipo do homem do Renascimento, alguém cuja curiosidade insaciável era igualada apenas pela sua capacidade de invenção. É considerado um dos maiores pintores de todos os tempos e como possivelmente a pessoa dotada de talentos mais diversos a ter vivido. Segundo a historiadora de arte Helen Gardner, a profundidade e o alcance de seus interesses não tiveram precedentes e "sua mente e personalidade parecem sobre-humanos para nós, e o homem em si [nos parece] misterioso e distante".
1473-1543, Nicolau Copérnico, Polônia. Astrônomo e matemático polonês que desenvolveu a teoria heliocêntrica do Sistema Solar. Foi também cónego da Igreja Católica, governador e administrador, jurista, astrônomo e médico. Sua teoria do Heliocentrismo, que colocou o Sol como o centro do Sistema Solar, contrariando a então vigente Teoria Geocêntrica (que considerava a Terra como o centro), é considerada como uma das mais importantes hipóteses científicas de todos os tempos, tendo constituído o ponto de partida da astronomia.
1493-1541, Paracelso, Suíça. O suíço Philippus Aureolus Theophrastus Bombastus Von Hohenheim, mais conhecido como Paracelso, era um conhecedor multifacetado. Ele estudou e escreveu sobre medicina e química, mas também sobre misticismo e filosofia. Foram as suas contribuições que iniciaram o processo de transformação da alquimia em química moderna. “Paracelso entendia a química como chave para a compreensão do universo”, explica o professor de história da ciência da USP Paulo Porto. E por isso sempre foi muito criticado. Quando jovem viajou pela Europa e Oriente Médio curando doentes. Mais tarde ganhou inimigos por todos os lados, quando, como professor, convidou o povo para uma aula aberta e queimou livros da medicina clássica em praça pública - um absurdo para a época. O cientista conhecia muito bem a alquimia e por isso identificou problemas na ciência clássica. Foi pioneiro ao dar à medicina princípios de uma filosofia química. Pela primeira vez, utilizou-se de remédios químicos e compostos metálicos dos alquimistas para criar tratamentos para diversas doenças como, por exemplo, a quimioterapia (com enxofre, cobre e mercúrio). A observação da natureza fez que com ele entendesse que a análise em laboratório da matéria era forma de se obter conhecimento.
1555-1616, Andreas Libavius, Alemanha. Médico e químico alemão, trabalhou como professor em Ilmenau, Jena. Em 1597, escreveu o primeiro livro sistemático de química, Alchemia, principalmente de operações químicas como, por exemplo, o preparo de diversos ácidos ácidos fortes. Algumas de suas obras foram publicadas sob o pseudônimo de Basilius de Varna.
1564-1642, Galileu Galilei, Itália. Físico, matemático, astrônomo e filósofo florentino, foi personalidade fundamental na revolução científica. Filho mais velho dos sete de seus pais, viveu grande parte de sua vida entre Pisa e Florença. Desenvolveu os primeiros estudos sistemáticos do movimento uniformemente acelerado e do movimento do pêndulo. Descobriu a lei dos corpos e enunciou o princípio da inércia e o conceito de referencial inercial, ideias precursoras da mecânica newtoniana. Galileu melhorou significativamente o telescópio refrator e com ele descobriu as manchas solares, as montanhas da Lua, as fases de Vénus, quatro dos satélites de Júpiter, os anéis de Saturno, as estrelas da Via Láctea. Estas descobertas contribuíram decisivamente na defesa do heliocentrismo. Contudo a principal contribuição de Galileu foi para o método científico, pois a ciência assentava numa metodologia aristotélica. O físico desenvolveu ainda vários instrumentos como a balança hidrostática, um tipo de compasso geométrico que permitia medir ângulos e áreas, o termômetro de Galileu e o precursor do relógio de pêndulo. O método empírico, defendido por Galileu, constitui um corte com o método aristotélico mais abstrato utilizado nessa época, devido a isto Galileu é considerado como o "pai da ciência moderna".
1579-1644, Jan Baptist Van Helmont, Bélgica. Químico e bioquímico, também era médico e fisiologista. Assim como Paracelso, estudou a magia e a ciência tradicional, mas, diferente do seu anterior, valorizou muito mais o trabalho experimental e quantitativo do que a filosofia. Rejeitou o que se conhecia anteriormente por elementos da matéria - Aristóteles definiu quatro (ar, terra, fogo e água) e, Paracelso, três (sal, enxofre e mercúrio). Para ele, a matéria constituía apenas de ar e a água. A partir daí, constatou que a fumaça de combustão não era similar ao ar e ao vapor de água, como se acreditava anteriormente. Acabou nomeando essas fumaças de gás e passou a considerar a existência de gases no ar e nas reações químicas. Investigou e classificou um grande número de gases, tais como o dióxido de carbono, monóxido de carbono, entre outros, originados de águas termais, da queima de carvão, da fermentação e das erupções das minas.
1596-1650, Renê Descartes, França. Renê Descartes demonstrou como a matemática poderia ser utilizada para descrever as formas e as medidas dos corpos, inventou a geometria analítica e desenvolveu o raciocínio matemático baseado, principalmente, na lógica dedutiva, em que nós partimos de uma verdade para encontrarmos outras verdades, ou seja, que uma verdade é consequência da outra. Discurso sobre o método, de 1636, é sua obra mais famosa, na qual procura nos convencer que o raciocínio matemático deveria servir de modelo para o pensamento filosófico e para todas as ciências. Uma das frases mais célebres da história do pensamento filosófico é: "Penso, logo existo". Ele acreditava que dessa verdade ninguém poderia duvidar.
1627-1691, Robert Boyle, Inglaterra. Com formação tradicional, o inglês, filho de Conde, deixou a filosofia para se dedicar à experimentação, ao construir um laboratório na sua casa em Sailbridge. Em 1664, chegou a Oxford, aonde produziu a maioria de seus trabalhos, dedicando-se também à física. Dando continuidade aos estudos de Helmont, publicou sobre a dilatação dos gases em The Septical Chymist (1661), diferenciando pela primeira vez a alquimia da química, ao definir, ainda que vagamente, os modernos conceitos de átomo e molécula. Ficou muito famoso também com a publicação de uma lista com 24 avanços científicos para a humanidade que aconteceriam futuramente. Ele previu, entre outros, submarinos, aviões, luz elétrica, modificação genética, transplantes de órgãos e a capacidade das cirurgias de prolongar a vida.
1643-1727, Isaac Newton, Inglaterra. Astrônomo, alquimista, filósofo natural, teólogo e cientista inglês, mais reconhecido como físico e matemático. Sua obra Princípios Matemáticos da Filosofia Natural é considerada uma das mais influentes na história da ciência. Publicada em 1687, esta obra descreve a lei da gravitação universal e as três leis de Newton, que fundamentaram a mecânica clássica. Ao demonstrar a consistência que havia entre o sistema por si idealizado e as leis de Kepler do movimento dos planetas, foi o primeiro a demonstrar que os movimentos de objetos, tanto na Terra como em outros corpos celestes, são governados pelo mesmo conjunto de leis naturais. O poder unificador e profético de suas leis era centrado na revolução científica, no avanço do heliocentrismo e na difundida noção de que a investigação racional pode revelar o funcionamento mais intrínseco da natureza. Newton construiu o primeiro telescópio refletor operacional e desenvolveu a teoria das cores baseada na observação de que um prisma decompõe a luz branca em várias cores do espectro visível. Ele também formulou uma lei empírica de resfriamento e estudou a velocidade do som. Além de seu trabalho em cálculo infinitesimal, como matemático Newton contribuiu para o estudo das séries de potências, generalizou o teorema binomial para expoentes não inteiros e desenvolveu o método de Newton para a aproximação das raízes de uma função, além de muitas outras contribuições importantes. Newton também dedicou muito de seu tempo ao estudo da alquimia e da cronologia bíblica, mas a maior parte de seu trabalho nessas áreas permaneceu não publicada até muito tempo depois de sua morte. Em uma pesquisa promovida pela Royal Society, Newton foi considerado o cientista que causou maior impacto na história da ciência.[2] De personalidade sóbria, fechada e solitária, para ele a função da ciência era descobrir leis universais e enunciá-las de forma precisa e racional.[3]
1659-1734, Georg Ernst Stahl, Alemanha. Médico e químico alemão, Stahl ficou conhecido principalmente pela criação da Teoria do Flogismo, publicada no livro "Os Fundamentos da Química". Baseando-se nos trabalhos de Johann Joachim Becher, ele chegou à conclusão de que quando um mineral ou metal fosse muito aquecido, ele entrava em combustão, liberava uma substância chamada de flogisto, sofria corrosão e perdia sua capacidade de combustão. Com isso, o químico começava a explicar os diversos efeitos envolvidos da combustão, ainda que não de maneira completamente correta. Seu estudo foi extremamente importante para o entendimento de processos biológicos como a fermentação, respiração e putrefação.
1736-1813, Joseph Louis Lagrange, Itália. Nascido como Giuseppe Lodovico Lagrangia (Turim, 25 de janeiro de — Paris, 10 de abril de ) foi um matemático italiano. O pai de Lagrange havia sido tesoureiro de guerra da Sardenha, tendo se casado com Marie-Thérèse Gros, filha de um rico físico. Foi o único de dez irmãos que sobreviveu à infância. Napoleão Bonaparte fez dele senador, conde do império e grande oficial da Legião de Honra.
1749-1827, Pierre-Simon, Marquês de Laplace, França. Matemático, astrônomo e físico francês, que organizou a astronomia matemática, resumindo e ampliando o trabalho de seus predecessores nos cinco volumes do seu Mécanique Céleste (Mecânica celeste) (1799-1825). Esta obra-prima traduziu o estudo geométrico da mecânica clássica usada por Isaac Newton para um estudo baseado em cálculo, conhecido como mecânica física.[1] Foi eleito membro da Royal Society em 1789. Ele também formulou a equação de Laplace. A transformada de Laplace aparece em todos os ramos da física matemática — campo em cuja formação teve um papel principal. O operador diferencial de Laplace, do qual depende muito a matemática aplicada, também recebe seu nome. Ele se tornou conde do Império em 1806 e foi nomeado marquês em 1817, depois da restauração dos Bourbons.
1743-1794, Antoine Lavoisier, França. A famosa frase “na natureza nada se cria, nada se perde, tudo se transforma” é a definição do químico francês para sua teoria de conservação da matéria. Ele descobriu que a combustão de uma matéria só acontece com o oxigênio (elemento que identificou e classificou), derrubando a teoria do alemão Stahl. Junto com Claude-Louis Berthollet, publicou o estudo "Método de Nomenclatura Química", propondo uma reforma na linguagem da química. Desvendou a composição química da água: dois átomos de hidrogênio e um de oxigênio. Além disso, com o clássico “Tratado Elementar da Química”, separou definitivamente a química da alquimia. A sua mania de sempre pesar na balança tudo o que analisava levou-o a descobrir que a soma das massas dos reagentes é igual a massa do produto de uma reação e criar a Lei de Conservação das Massas.
1766-1844, John Dalton, Inglaterra. Químico, meteorologista e físico britânico, foi um dos primeiros cientistas a defender que a matéria é feita de pequenas partículas, os átomos. É também um dos pioneiros na meteorologia, iniciando suas observações em 1787 com instrumentos confeccionados por ele mesmo e publicando, seis anos mais tarde, o livro Meteorological Observations and Essays (Observações e Ensaios Meteorológicos), um dos primeiros concernentes à ciência meteorológica. Suas observações experimentais permitiram-lhe elaborar teorias sobre o vapor d'água e misturas de gases, apresentando em 1801 sua lei das pressões parciais: em uma mistura de gases, cada componente exerce a mesma pressão como se estivesse solitária no recipiente que a contém. Dalton concluiu que toda a matéria, não apenas gases, deve se consistir de diminutas partículas. Reviveu, assim, a antiga teoria atômica e elaborou a primeira tabela de pesos atômicos, anunciando seus resultados em 1803. Ao fim de sua vida, sua teoria atômica estava amplamente difundida entre a comunidade química e reconhecida pelo rei da Inglaterra com a Medalha Real.
1805-1865, William Rowan Hamilton, Irlanda. Matemático, físico e astrônomo irlandês. Contribuiu com trabalhos fundamentais ao desenvolvimento da óptica, dinâmica e álgebra. A sua descoberta mais importante em matemática é a dos quaterniões. Em física é muito conhecido pelo seu trabalho em mecânica analítica, que veio a ser influente nas áreas da mecânica quântica e da teoria quântica de campos. Em sua homenagem são designados os hamiltonianos, por ele inventados.
1834-1907, Dimitri Mendeleev, Rússia. O químico russo tinha uma personalidade muito forte, por isso só conseguia trabalhar sozinho. Criou um laboratório improvisado em seu apartamento, aonde fez descobertas importantes sobre estruturas atômicas, valência (capacidade de um átomo de se combinar com outros) e propriedades dos gases. Quando ele descobriu que as propriedades dos átomos decorriam de sua massa, criou uma tabela com 63 quadrados, cada qual com o símbolo de um elemento, sua massa atômica e suas propriedades físicas e químicas; e foram agrupados em ordem crescende de suas massas. Era a primeira versão da tabela periódica. A classificação de Mendeleev tinha ainda espaços em branco, o que indica que ele previa a descoberta de novos elementos.
Na evolução da história da química vários modelos foram propostos ao longo do tempo.
Modelo de Dalton
Ideias sobre a constituição da matéria (o átomo) surgiram na Grécia antiga, por volta de 450 a.C., a partir, principalmente, de Demócrito e Leucipo. No entanto, o átomo só recebeu de fato um caráter científico a partir da chamada Teoria Atômica de Dalton.
A Teoria Atômica de Dalton foi fundamental para o desenvolvimento do conhecimento atômico, pois serviu de base para que outros cientistas conhecessem o átomo e suas características.
John Dalton, químico por formação, nasceu no condado de Cumbria, Inglaterra, em 1766 e faleceu na cidade de Manchester, em 1844. Sua vida foi destinada desde cedo à pesquisa científica e ao magistério, tanto que lecionou ou contribuiu para o desenvolvimento de diversas áreas do conhecimento.
Seu maior legado como cientista, no entanto, foi o desenvolvimento da primeira teoria atômica. Foi por meio de vários experimentos relacionados com a mistura de gases e do conhecimento dos trabalhos propostos por Lavoisier que surgiu a teoria atômica de Dalton em 1808.
Postulados da teoria atômica de Dalton
A teoria atômica de Dalton foi baseada em experimentos, mas nenhum desses experimentos conseguiu revelar o átomo claramente. Por isso, Dalton denominava o átomo como a menor parte da matéria.
A teoria de Dalton apresenta muito mais postulados do que comprovações. Veja alguns deles:
-
Os átomos são maciços e apresentam forma esférica (semelhantes a uma bola de bilhar);
-
Os átomos são indivisíveis;
-
Os átomos são indestrutíveis;
-
Um elemento químico é um conjunto de átomos com as mesmas propriedades (tamanho e massa);
-
Os átomos de diferentes elementos químicos apresentam propriedades diferentes uns dos outros;
-
O peso relativo de dois átomos pode ser utilizado para diferenciá-los;
-
Uma substância química composta é formada pela mesma combinação de diferentes tipos de átomos;
-
Substâncias químicas diferentes são formadas pela combinação de átomos diferentes.
Representações do modelo atômico de Dalton
Dalton nomeou o seu modelo atômico de bola de bilhar e, por isso, passou a representar os átomos dos elementos conhecidos em sua época por meio de símbolos esféricos.
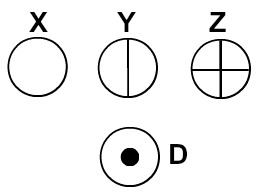
Átomos representados segundo a teoria atômica de Dalton
Cada representação atômica que apresenta um detalhe específico indica um elemento químico diferente. Didaticamente os livros e exercícios de nível fundamental e médio representam os átomos apenas por esferas com cores diferentes.
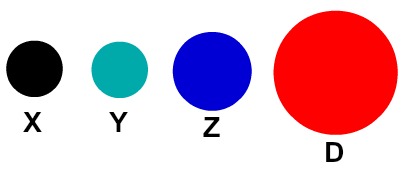
Representação didática dos átomos
Contribuições da teoria atômica de Dalton
Compreensão da Lei da conservação da massa de Lavoisier
O químico francês Lavoisier afirmou, em 1785, que “em uma reação química massa se conserva porque não ocorre criação nem destruição de átomos ”. A teoria atômica de Dalton comprovou esse fato, já que um dos seus postulados afirma que o átomo é indestrutível.
Sendo assim, se realizarmos a combustão do carvão (C) na presença de gás oxigênio (O2), teremos uma reação química entre um átomo de carbono e dois átomos de oxigênio. Essa reação formará o gás carbônico (CO2), que possui exatamente os mesmos átomos que compunham as substâncias antes da reação.
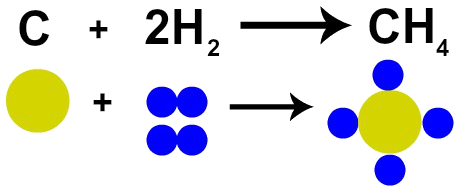
Representação da Lei de Lavoisier pelo modelo atômico de Dalton
Compreensão das substâncias simples
Utilizando o modelo atômico de Dalton, podemos compreender uma substância simples, isto é, aquela que possui átomos de mesma característica formando uma molécula. Logo, temos átomos pertencentes a um mesmo elemento químico.
Na substância F2, por exemplo, temos dois átomos de flúor, por isso, devemos utilizar dois tipos de átomos iguais na representação segundo a teoria atômica de Dalton.

Representação de substância simples segundo o modelo atômico de Dalton
Compreensão das substâncias compostas
Em uma substância composta, temos átomos de características diferentes formando a molécula. Logo, temos elementos químicos diferentes formando a substância.
A substância H2O, por exemplo, apresenta três átomos: dois de hidrogênio e um de oxigênio. Veja sua representação segunda o modleo atômico de Dalton:

Representação de uma substância composta segundo o pelo modelo atômico de Dalton
Compreensão das misturas
A compreensão de uma mistura (união de duas ou mais substâncias diferentes) por intermédio da teoria atômica de Dalton é simples: basta colocarmos duas moléculas diferentes em um mesmo recipiente.

Representação de uma mistura segundo o modelo atômico de Dalton
Outras contribuições científicas de John Dalton:
-
Introduziu o conceito de massa atômica;
-
Formulou a lei das pressões parciais dos gases (Lei de Dalton);
-
Descobriu a deficiência visual denominada de daltonismo;
-
Estudou o comportamento de vapores e gases em diferentes temperaturas;
-
Descobriu que todos os gases expandem-se (procuram ocupar um determinado local) no espaço da mesma forma.
Modelo de Thomson
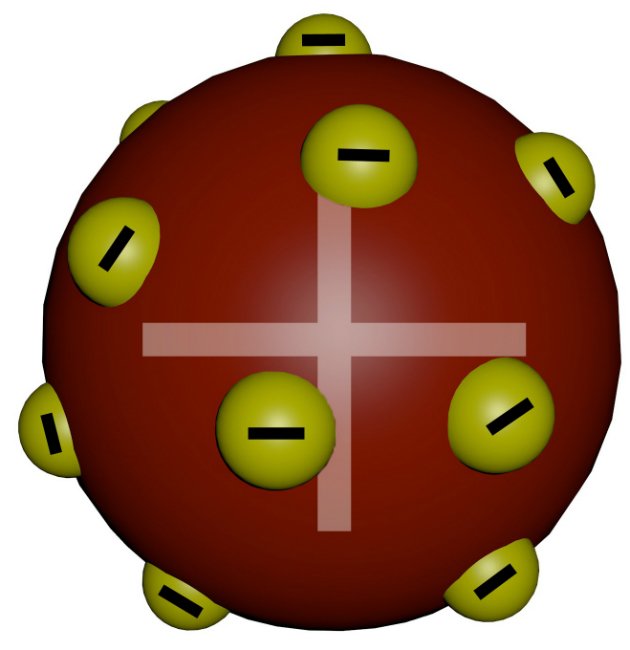
O Modelo Atômico de Thomson foi o primeiro a realizar a divisibilidade do átomo. Ao pesquisar sobre raios catódicos, o físico inglês propôs esse modelo que ficou conhecido como o modelo pudim de ameixa.
Ele demonstrou que esses raios podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa.
Em 1887, Thomson sugeriu que os elétrons eram um constituinte universal da matéria. Ele apresentou as primeiras ideias relativas à estrutura interna dos átomos.
Thomson indicava que os átomos deviam ser constituídos de cargas elétricas positivas e negativas distribuídas uniformemente.
Ele descobriu essa mínima partícula e assim estabeleceu a teoria da natureza elétrica da matéria. Concluiu que os elétrons eram constituintes de todos os tipos de matéria, pois observou que a relação carga/massa do elétron era a mesma para qualquer gás empregado em suas experiências.
Em 1897, Thomson tornou-se reconhecido como o pai do elétron.
Modelo de Rutherford
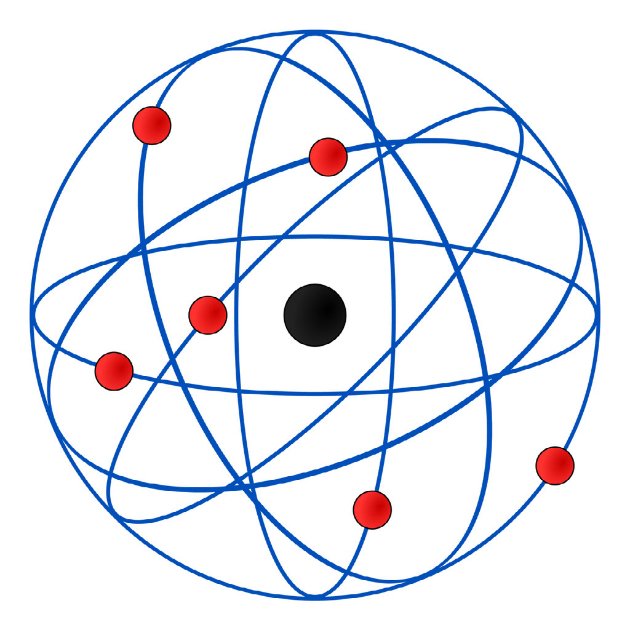
Em 1911, o físico neozelandês Rutherford colocou uma folha de ouro bastante fina dentro de uma câmara metálica. Seu objetivo era analisar a trajetória de partículas alfa a partir do obstáculo criado pela folha de ouro.
Nesse ensaio de Rutherford, observou que algumas partículas ficavam totalmente bloqueadas e outras partículas, que não eram afetadas, ultrapassavam a folha sofrendo desvios. Segundo ele, esse comportamento podia ser explicados graças às forças de repulsão elétrica entre essas partículas.
Pelas observações, afirmou que o átomo era nucleado e sua parte positiva se concentrava num volume extremamente pequeno, que seria o próprio núcleo.
O Modelo Atômico de Rutherford, conhecido como modelo planetário, corresponde a um sistema planetário em miniatura, no qual os elétrons se movem em órbitas circulares, ao redor do núcleo.
Modelo de Rutherford – Bohr
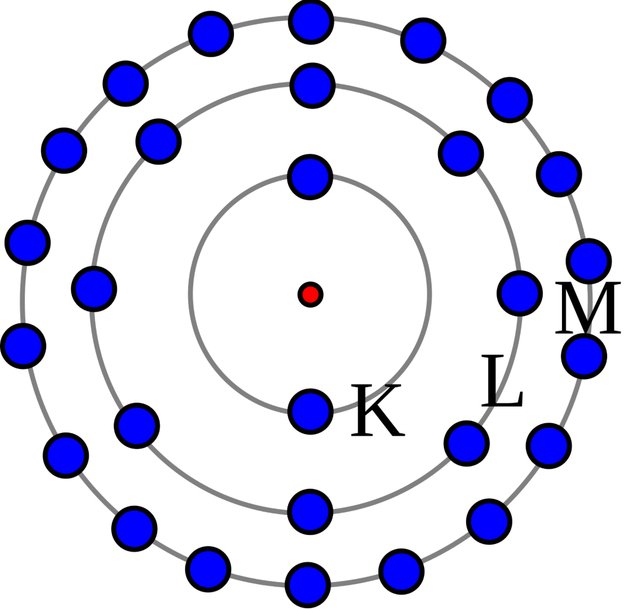
O modelo apresentado por Rutherford foi aperfeiçoado por Bohr. Por esse motivo, o aspecto da estrutura atômica de Bohr também é chamada de Modelo Atômico de Bohr ou Modelo Atômico de Rutherford-Bohr.
A teoria do físico dinamarquês Niels Bohr estabeleceu as seguintes concepções atômicas:
- Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
- O átomo é incrivelmente pequeno, mesmo assim a maior parte do átomo é espaço vazio. O diâmetro do núcleo atômico é cerca de cem mil vezes menor que o átomo todo. Os elétrons giram tão depressa que parecem tomar todo o espaço.
- Quando a eletricidade passa através do átomo, o elétron pula para a órbita maior e seguinte, voltando depois à sua órbita usual.
- Quando os elétrons saltam de uma órbita para a outra resulta luz. Bohr conseguiu prever os comprimentos de onda a partir da constituição do átomo e do salto dos elétrons de uma órbita para a outra.
Modelo de Sommerfeld
O modelo atômico de Rutherford-Bohr explicava de maneira satisfatória o comportamento do elétron no átomo de hidrogênio. Cientistas, ao tentar replicar a teoria nos elementos que possuíam mais elétrons, encontraram discrepâncias entre o postulado teórico e a realidade obtida nos espectros de emissão.
Os espectros de emissão de átomos com mais elétrons apresentavam uma singularidade: eram formados por um conjunto de linhas. A este conjunto denominou-se espectro de raia e a análise dos mesmos permitiu aos cientistas concluir que, uma vez excitados, elétrons de uma mesma camada apresentam comportamento espectral semelhante. Eles também intuíram sobre o nível de energia das camadas onde os elétrons circulavam, pois as linhas de uma raia apresentavam-se muito próximas, especulavam-se próximos os valores de energia.
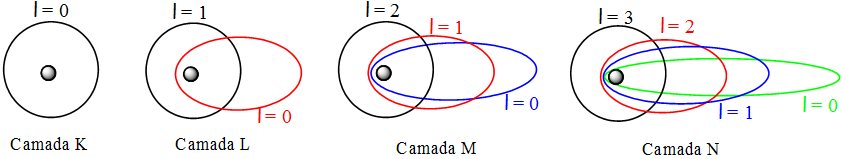
Arnold. J. W. Sommerfeld, em 1916, interpretou espectros com múltiplas linhas justapostas e segundo ele, as camadas enunciadas por Bohr (K, L, M, N...) eram constituídas por subcamadas, de órbitas elípticas e de diferentes momentos angulares, conforme exibe a figura a seguir.
As órbitas elípticas de Sommerfeld indicaram um segundo número quântico, denominado número quântico secundário (l).
Este número quântico secundário, definido pela equação l = n – 1 descreveria as subcamadas de energia e por consequência, seu momento angular.
Para a camada M (n=3) teremos para o valor do número quântico secundário l = 2.
Conforme se observa na figura acima, teremos para a camada M três órbitas possíveis (0, 1 e 2), sendo a órbita de maior valor a mais arredondada e onde o elétron possuirá o maior nível de energia.
A proposta de Sommerfeld conseguira, através da instituição do segundo número quântico, explicar como os espectros de emissão apresentavam o fenômeno de linhas múltiplas nas raias espectrais.
Segundo este modelo, as múltiplas linhas seriam os subníveis de energia que compõem o nível ou camada de energia e estes subníveis foram caracterizados como “s”, “p”, “d” e “f”, derivados de conceitos relativos à espectroscopia.
Sommerfeld, ao manter preceitos do modelo de Bohr, determinou intacta a natureza quântica do elétron.
Os subníveis de energia explicavam a existência de espectros compostos por linhas justapostas, embora ainda se mantivessem dúvidas acerca de espectros obtidos sob a ação de intensos campos magnéticos.
Sob a ação de campos magnéticos, o espectro se decompõe, exibindo novas bandas espectrais.
Para explicar o surgimento destas bandas, foi proposto que o elétron reagiria ao campo magnético acumulando determinado valor de energia e isso alteraria o seu momento magnético. Tal proposição permitiu a determinação do terceiro número quântico, o número quântico magnético (ml).
A análise dos espectros finos da primeira série de Balmer apontou a existência de duas linhas muito próximas. Foi proposto para este comportamento o quarto número quântico, o número quântico de spin (ms).
Sendo o elétron uma partícula que possui um eixo imaginário, o mesmo executaria movimento de rotação sobre o mesmo, girando (spin) em dois sentidos: o paralelo e o antiparalelo.
Esta concepção levou ao princípio de exclusão enunciado por Wolfgang Pauli, que indica não existir, em um mesmo átomo, dois elétrons iguais.
O físico francês Louis de Broglie, já em meados da década de 1920 afirmara que o elétron apresentaria a natureza “onda-partícula”, o que acabou por permitir a evolução do modelo Sommerfeld – Bohr.