Na evolução da história da química vários modelos foram propostos ao longo do tempo.
Modelo de Dalton
Ideias sobre a constituição da matéria (o átomo) surgiram na Grécia antiga, por volta de 450 a.C., a partir, principalmente, de Demócrito e Leucipo. No entanto, o átomo só recebeu de fato um caráter científico a partir da chamada Teoria Atômica de Dalton.
A Teoria Atômica de Dalton foi fundamental para o desenvolvimento do conhecimento atômico, pois serviu de base para que outros cientistas conhecessem o átomo e suas características.
John Dalton, químico por formação, nasceu no condado de Cumbria, Inglaterra, em 1766 e faleceu na cidade de Manchester, em 1844. Sua vida foi destinada desde cedo à pesquisa científica e ao magistério, tanto que lecionou ou contribuiu para o desenvolvimento de diversas áreas do conhecimento.
Seu maior legado como cientista, no entanto, foi o desenvolvimento da primeira teoria atômica. Foi por meio de vários experimentos relacionados com a mistura de gases e do conhecimento dos trabalhos propostos por Lavoisier que surgiu a teoria atômica de Dalton em 1808.
Postulados da teoria atômica de Dalton
A teoria atômica de Dalton foi baseada em experimentos, mas nenhum desses experimentos conseguiu revelar o átomo claramente. Por isso, Dalton denominava o átomo como a menor parte da matéria.
A teoria de Dalton apresenta muito mais postulados do que comprovações. Veja alguns deles:
-
Os átomos são maciços e apresentam forma esférica (semelhantes a uma bola de bilhar);
-
Os átomos são indivisíveis;
-
Os átomos são indestrutíveis;
-
Um elemento químico é um conjunto de átomos com as mesmas propriedades (tamanho e massa);
-
Os átomos de diferentes elementos químicos apresentam propriedades diferentes uns dos outros;
-
O peso relativo de dois átomos pode ser utilizado para diferenciá-los;
-
Uma substância química composta é formada pela mesma combinação de diferentes tipos de átomos;
-
Substâncias químicas diferentes são formadas pela combinação de átomos diferentes.
Representações do modelo atômico de Dalton
Dalton nomeou o seu modelo atômico de bola de bilhar e, por isso, passou a representar os átomos dos elementos conhecidos em sua época por meio de símbolos esféricos.
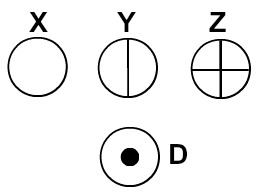
Átomos representados segundo a teoria atômica de Dalton
Cada representação atômica que apresenta um detalhe específico indica um elemento químico diferente. Didaticamente os livros e exercícios de nível fundamental e médio representam os átomos apenas por esferas com cores diferentes.
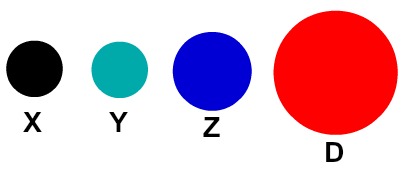
Representação didática dos átomos
Contribuições da teoria atômica de Dalton
Compreensão da Lei da conservação da massa de Lavoisier
O químico francês Lavoisier afirmou, em 1785, que “em uma reação química massa se conserva porque não ocorre criação nem destruição de átomos ”. A teoria atômica de Dalton comprovou esse fato, já que um dos seus postulados afirma que o átomo é indestrutível.
Sendo assim, se realizarmos a combustão do carvão (C) na presença de gás oxigênio (O2), teremos uma reação química entre um átomo de carbono e dois átomos de oxigênio. Essa reação formará o gás carbônico (CO2), que possui exatamente os mesmos átomos que compunham as substâncias antes da reação.
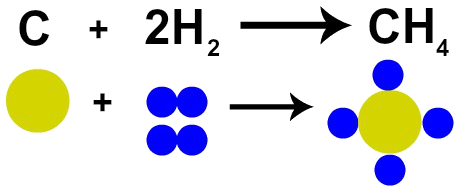
Representação da Lei de Lavoisier pelo modelo atômico de Dalton
Compreensão das substâncias simples
Utilizando o modelo atômico de Dalton, podemos compreender uma substância simples, isto é, aquela que possui átomos de mesma característica formando uma molécula. Logo, temos átomos pertencentes a um mesmo elemento químico.
Na substância F2, por exemplo, temos dois átomos de flúor, por isso, devemos utilizar dois tipos de átomos iguais na representação segundo a teoria atômica de Dalton.

Representação de substância simples segundo o modelo atômico de Dalton
Compreensão das substâncias compostas
Em uma substância composta, temos átomos de características diferentes formando a molécula. Logo, temos elementos químicos diferentes formando a substância.
A substância H2O, por exemplo, apresenta três átomos: dois de hidrogênio e um de oxigênio. Veja sua representação segunda o modleo atômico de Dalton:

Representação de uma substância composta segundo o pelo modelo atômico de Dalton
Compreensão das misturas
A compreensão de uma mistura (união de duas ou mais substâncias diferentes) por intermédio da teoria atômica de Dalton é simples: basta colocarmos duas moléculas diferentes em um mesmo recipiente.

Representação de uma mistura segundo o modelo atômico de Dalton
Outras contribuições científicas de John Dalton:
-
Introduziu o conceito de massa atômica;
-
Formulou a lei das pressões parciais dos gases (Lei de Dalton);
-
Descobriu a deficiência visual denominada de daltonismo;
-
Estudou o comportamento de vapores e gases em diferentes temperaturas;
-
Descobriu que todos os gases expandem-se (procuram ocupar um determinado local) no espaço da mesma forma.
Modelo de Thomson
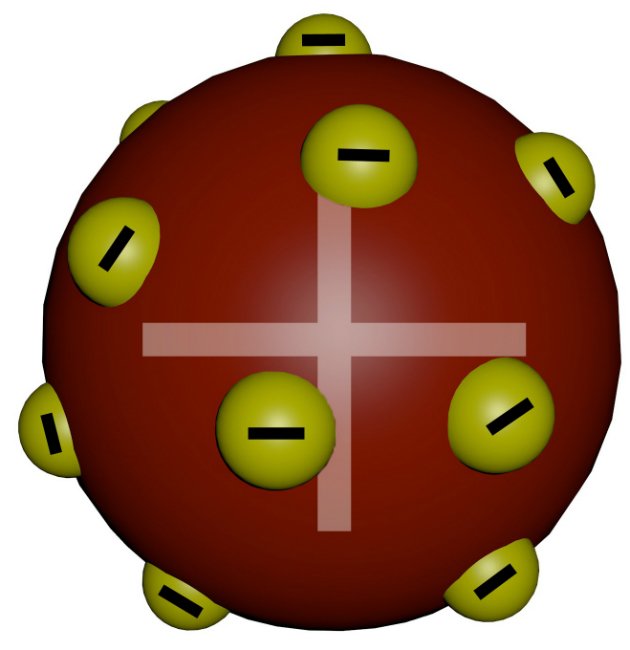
O Modelo Atômico de Thomson foi o primeiro a realizar a divisibilidade do átomo. Ao pesquisar sobre raios catódicos, o físico inglês propôs esse modelo que ficou conhecido como o modelo pudim de ameixa.
Ele demonstrou que esses raios podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa.
Em 1887, Thomson sugeriu que os elétrons eram um constituinte universal da matéria. Ele apresentou as primeiras ideias relativas à estrutura interna dos átomos.
Thomson indicava que os átomos deviam ser constituídos de cargas elétricas positivas e negativas distribuídas uniformemente.
Ele descobriu essa mínima partícula e assim estabeleceu a teoria da natureza elétrica da matéria. Concluiu que os elétrons eram constituintes de todos os tipos de matéria, pois observou que a relação carga/massa do elétron era a mesma para qualquer gás empregado em suas experiências.
Em 1897, Thomson tornou-se reconhecido como o pai do elétron.
Modelo de Rutherford
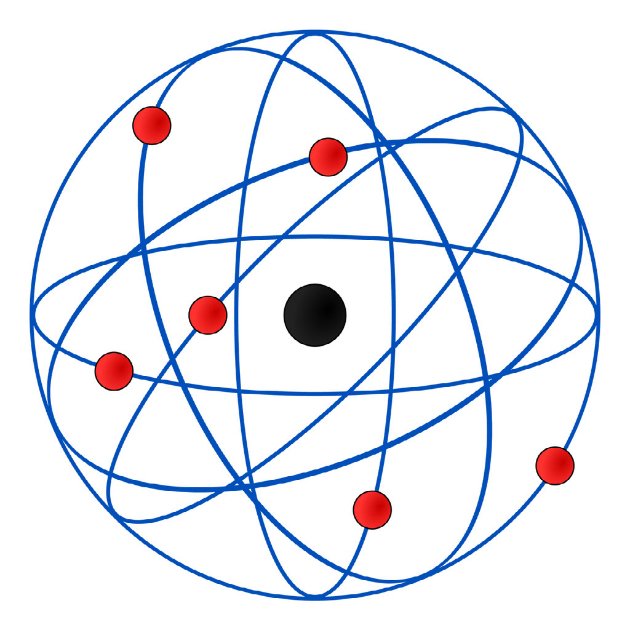
Em 1911, o físico neozelandês Rutherford colocou uma folha de ouro bastante fina dentro de uma câmara metálica. Seu objetivo era analisar a trajetória de partículas alfa a partir do obstáculo criado pela folha de ouro.
Nesse ensaio de Rutherford, observou que algumas partículas ficavam totalmente bloqueadas e outras partículas, que não eram afetadas, ultrapassavam a folha sofrendo desvios. Segundo ele, esse comportamento podia ser explicados graças às forças de repulsão elétrica entre essas partículas.
Pelas observações, afirmou que o átomo era nucleado e sua parte positiva se concentrava num volume extremamente pequeno, que seria o próprio núcleo.
O Modelo Atômico de Rutherford, conhecido como modelo planetário, corresponde a um sistema planetário em miniatura, no qual os elétrons se movem em órbitas circulares, ao redor do núcleo.
Modelo de Rutherford – Bohr
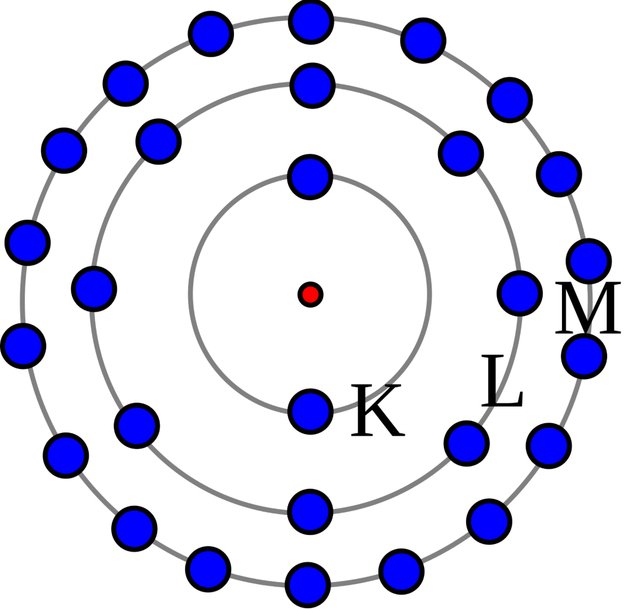
O modelo apresentado por Rutherford foi aperfeiçoado por Bohr. Por esse motivo, o aspecto da estrutura atômica de Bohr também é chamada de Modelo Atômico de Bohr ou Modelo Atômico de Rutherford-Bohr.
A teoria do físico dinamarquês Niels Bohr estabeleceu as seguintes concepções atômicas:
- Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
- O átomo é incrivelmente pequeno, mesmo assim a maior parte do átomo é espaço vazio. O diâmetro do núcleo atômico é cerca de cem mil vezes menor que o átomo todo. Os elétrons giram tão depressa que parecem tomar todo o espaço.
- Quando a eletricidade passa através do átomo, o elétron pula para a órbita maior e seguinte, voltando depois à sua órbita usual.
- Quando os elétrons saltam de uma órbita para a outra resulta luz. Bohr conseguiu prever os comprimentos de onda a partir da constituição do átomo e do salto dos elétrons de uma órbita para a outra.
Modelo de Sommerfeld
O modelo atômico de Rutherford-Bohr explicava de maneira satisfatória o comportamento do elétron no átomo de hidrogênio. Cientistas, ao tentar replicar a teoria nos elementos que possuíam mais elétrons, encontraram discrepâncias entre o postulado teórico e a realidade obtida nos espectros de emissão.
Os espectros de emissão de átomos com mais elétrons apresentavam uma singularidade: eram formados por um conjunto de linhas. A este conjunto denominou-se espectro de raia e a análise dos mesmos permitiu aos cientistas concluir que, uma vez excitados, elétrons de uma mesma camada apresentam comportamento espectral semelhante. Eles também intuíram sobre o nível de energia das camadas onde os elétrons circulavam, pois as linhas de uma raia apresentavam-se muito próximas, especulavam-se próximos os valores de energia.
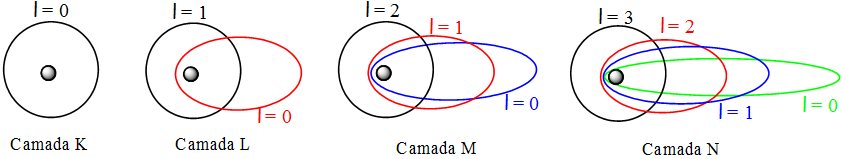
Arnold. J. W. Sommerfeld, em 1916, interpretou espectros com múltiplas linhas justapostas e segundo ele, as camadas enunciadas por Bohr (K, L, M, N...) eram constituídas por subcamadas, de órbitas elípticas e de diferentes momentos angulares, conforme exibe a figura a seguir.
As órbitas elípticas de Sommerfeld indicaram um segundo número quântico, denominado número quântico secundário (l).
Este número quântico secundário, definido pela equação l = n – 1 descreveria as subcamadas de energia e por consequência, seu momento angular.
Para a camada M (n=3) teremos para o valor do número quântico secundário l = 2.
Conforme se observa na figura acima, teremos para a camada M três órbitas possíveis (0, 1 e 2), sendo a órbita de maior valor a mais arredondada e onde o elétron possuirá o maior nível de energia.
A proposta de Sommerfeld conseguira, através da instituição do segundo número quântico, explicar como os espectros de emissão apresentavam o fenômeno de linhas múltiplas nas raias espectrais.
Segundo este modelo, as múltiplas linhas seriam os subníveis de energia que compõem o nível ou camada de energia e estes subníveis foram caracterizados como “s”, “p”, “d” e “f”, derivados de conceitos relativos à espectroscopia.
Sommerfeld, ao manter preceitos do modelo de Bohr, determinou intacta a natureza quântica do elétron.
Os subníveis de energia explicavam a existência de espectros compostos por linhas justapostas, embora ainda se mantivessem dúvidas acerca de espectros obtidos sob a ação de intensos campos magnéticos.
Sob a ação de campos magnéticos, o espectro se decompõe, exibindo novas bandas espectrais.
Para explicar o surgimento destas bandas, foi proposto que o elétron reagiria ao campo magnético acumulando determinado valor de energia e isso alteraria o seu momento magnético. Tal proposição permitiu a determinação do terceiro número quântico, o número quântico magnético (ml).
A análise dos espectros finos da primeira série de Balmer apontou a existência de duas linhas muito próximas. Foi proposto para este comportamento o quarto número quântico, o número quântico de spin (ms).
Sendo o elétron uma partícula que possui um eixo imaginário, o mesmo executaria movimento de rotação sobre o mesmo, girando (spin) em dois sentidos: o paralelo e o antiparalelo.
Esta concepção levou ao princípio de exclusão enunciado por Wolfgang Pauli, que indica não existir, em um mesmo átomo, dois elétrons iguais.
O físico francês Louis de Broglie, já em meados da década de 1920 afirmara que o elétron apresentaria a natureza “onda-partícula”, o que acabou por permitir a evolução do modelo Sommerfeld – Bohr.