Partículas subatômicas
Embora o significado original do termo átomo correspondesse a uma partícula que não pode ser dividida em partículas menores, no contexto científico contemporâneo o átomo é constituído por várias partículas subatômicas: o elétron, o próton e o nêutron. No entanto, há exceções: um átomo de hidrogênio-1 não tem nêutrons e um íon hidrogênio não tem elétrons.
O elétron é a partícula com menor massa, com apenas 9,11 x10-31 kg, tendo carga elétrica negativa e uma dimensão de tal modo reduzida que não é possível a sua medição com a tecnologia atual.
O próton tem carga positiva e massa 1 836 vezes maior do que a dos elétrons – 1,6726 x 10-27 kg. O nêutron não possui carga elétrica e tem massa 1 839 vezes superior à massa do elétron, ou 1,6929 x 10-27 kg.
Nêutrons e prótons possuem dimensões comparáveis, na ordem de 2,5 x10-15 m, embora a superfície destas partículas não tenha contornos precisos.
No modelo padrão da física de partículas, os elétrons são partículas verdadeiramente elementares sem qualquer estrutura interna. No entanto, tanto os protões como os nêutrons são partículas compostas, formadas por partículas denominadas quarks. Os protões são constituídos por dois quarks up (cada um com carga +2⁄3) e um quark down (com carga −1⁄3). Os nêutrons são constituídos por um quark up e dois quarks down. Esta diferença é responsável pelos diferentes valores de massa e carga entre as duas partículas. Os quarks mantêm-se unidos através da força forte, mediada pelos gluons. Por outro lado, os protões e nêutrons mantêm-se unidos através da força nuclear, um resíduo da força forte com propriedades diferentes. O gluon é um membro da família dos bosons de calibre, que são partículas elementares que medeiam a forças físicas.
Núcleo
O conjunto dos protões e nêutrons ligados entre si num átomo formam um pequeno núcleo atómico. Estes elementos que formam o núcleo são denominados coletivamente por núcleons.
O raio de um núcleo é aproximadamente igual a 1,07 3√A fm, onde A é o número total de nucleões. Este valor é muito inferior ao raio do próprio átomo, que é da ordem dos 105 fm.
Os núcleons mantêm-se unidos através de um potencial atrativo de curto alcance denominado força nuclear residual. A distâncias inferiores a 2,5 fm, esta força é muito mais poderosa que a força eletrostática, o que faz com que os protões de carga positiva se repelem mutuamente.
Os átomos de um mesmo elemento químico têm sempre o mesmo número de protões, o qual é denominado número atômico. Entre cada elemento, o número de nêutrons pode variar, determinando desta forma o isótopo desse elemento. O número total de protões e nêutrons determina o nuclídeo. O número de protões relativamente ao número de nêutrons determina a estabilidade do núcleo, havendo determinados isótopos que são radioativos.
Os nêutrons e protões são tipos diferentes de férmions. O Princípio de exclusão de Pauli é um princípio de mecânica quântica que proíbe que férmions idênticos, tais como múltiplos protões, ocupem o mesmo estado físico quântico ao mesmo tempo. Por conseguinte, todos os protões no núcleo devem ocupar um estado diferente, com um nível de energia próprio, aplicando-se a mesma regra a todos os nêutrons. Esta proibição não se aplica a um próton e nêutron que ocupem o mesmo estado quântico.
Nos átomos com números atómicos baixos, um núcleo que tenha um número de protões diferente do número de nêutrons pode decair para um estado de energia inferior através de radioatividade, de forma a que o número de protões e elétrons seja igualado. Por este motivo, os átomos com número semelhante de protões e nêutrons são mais estáveis em relação à radioatividade. No entanto, à medida que o número atómico aumenta, a repulsa mútua entre os protões requer uma proporção cada vez maior de nêutrons para manter a estabilidade do núcleo. Assim, não existem núcleos estáveis com o mesmo número de protões e nêutrons acima do número atómico 20 (cálcio) e, à medida que o valor aumenta, o rácio entre protões e nêutrons necessário à estabilidade aumenta para cerca de 1,5.
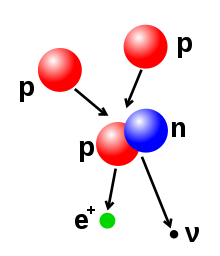
O número de protões e nêutrons no núcleo atómico pode ser alterado, embora possa ser necessária grande quantidade de energia para vencer a força forte. A fusão nuclear ocorre quando várias partículas atómicas se juntam para formar um núcleo mais pesado, como no caso da colisão entre dois núcleos. Por exemplo, no interior do Sol os protões necessitam de energia na ordem dos 3–10 keV para vencer a sua repulsa mútua - a barreira de Coulomb - e se fundirem num único núcleo. A fissão nuclear é o processo oposto, na qual o núcleo se divide em dois núcleos menores, normalmente através de radioatividade. O núcleo também pode ser modificado através do bombardeio com partículas subatómicas de elevada energia ou fotões. Se isto modificar o número de protões dentro do núcleo, o átomo muda para um elemento químico diferente.
Se, depois de uma reação de fusão, a massa de um núcleo for menor que a soma das massas das várias partículas, a diferença entre estes dois valores pode ser emitida através de energia útil (como raios gama ou a energia cinética de uma partícula beta), tal como descrito na fórmula de equivalência massa-energia de Einstein E = mc2, na qual m é a perda de massa e c é a velocidade da luz. Este défice é parte da energia de ligação do novo núcleo, sendo a perda irrecuperável de energia que faz com que as partículas fundidas se mantenham juntas.
A fusão de dois núcleos que dêem origem a núcleos maiores com números atómicos inferiores aos do ferro e níquel (60) é geralmente uma reação exotérmica que libera mais energia do que aquela necessária para os fundir. É este processo de libertação de energia que faz da fusão nuclear em estrelas uma reação auto sustentável. Em núcleos mais pesados, a energia de ligação por cada nucleão dentro do núcleo começa a ser cada vez menor. Isto significa que os processos de fusão que produzam núcleos com número atómico superior a 26 e massa atómica superior a 60 são reações endergônicas. Estes núcleos de maior massa não são capazes de dar origem a uma reação de fusão produtora de energia que sustente o equilíbrio hidrostático de uma estrela.
Nuvem de elétrons
Os elétrons de um átomo são atraídos para os protões do núcleo por meio da força eletromagnética. Esta força prende os elétrons no interior de um poço de potencial eletrostático em redor do núcleo mais pequeno, o que significa que é necessária uma fonte de energia externa para o elétron escapar. Quando mais perto está o elétron do núcleo, maior a força de atração. Assim, os elétrons que estejam ligados mais perto do centro do poço de potencial requerem mais energia para escapar do que aqueles na periferia.
Os elétrons, tal como outras partículas, têm propriedades tanto de partícula como de onda. A nuvem de elétrons é uma região no interior do poço de potencial na qual cada elétron forma um tipo de onda estacionária tridimensional - uma onda que não se move em relação ao núcleo. Este comportamento é definido por uma orbital atómica, uma função matemática que caracteriza a probabilidade de um elétron aparentar estar em determinada localização quando a sua posição é medida. Só existe um número limitado de orbitais em redor do núcleo, uma vez que outros possíveis padrões de onda rapidamente decaem para formas mais estáveis. As orbitais podem ter um ou mais anéis ou nós, e diferem entre si em termos de tamanho, forma e direção.
Cada orbital atómica corresponde a um determinado nível de energia de um elétron. Um elétron pode alterar o seu estado para um nível de energia superior ao absorver um fotão com energia suficiente para o impulsionar para o novo estado quântico. De forma semelhante, através de emissão espontânea, um elétron que se encontre num estado superior de energia pode descer para um estado inferior ao emitir a energia em excesso através de fotões. Estes valores de energia característicos, definidos pelas diferenças de energia nos estados quânticos, são responsáveis pelas linhas espectrais atómicas.
A quantidade de energia necessária para remover ou acrescentar um elétron - a energia de ligação de elétrons – é muito inferior à energia de ligação de nucleões. Por exemplo, só são necessários 13,6 eV para remover um elétron de um átomo de hidrogênio que esteja no nível fundamental, em comparação com os 2,23 milhões eV para dividir um núcleo de deutério. Os átomos são eletricamente neutros quando têm um número igual de protões e elétrons. Os átomos que têm défice ou excesso de elétrons são denominados íons. Os elétrons mais afastados do núcleo podem ser transferidos para outros átomos ou partilhados entre átomos. Através deste mecanismo, os átomos são capazes de se ligar em moléculas ou outros tipos de compostos químicos como cristais iónicos ou covalentes.