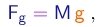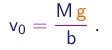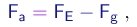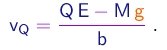Surgimento da Física Moderna
Átomos e moléculas
Origens da visão atômica da matéria
Embora a nossa percepção nos apresente a matéria como contínua, a noção de que ela poderia na verdade ser constituída de corpúsculos demasiadamente pequenos para serem enxergados individualmente já tinha surgido na antiguidade, tanto na civilização occidental como na oriental.
Na Grécia, os filósofos Leucippus1 e Democritus2 são tidos pelos historiadores como “atomistas”, embora nenhum dos seus escritos tenha chegado até nós. Apenas podemos apreciar as suas idéias através de relatos escritos por outros, em especial a obra De Rerum Natura (Sobre a Natureza das Coisas) do poeta epicuriano Lucretius3.
A preocupação central que parece ter levado pensadores antigos a postular a existência de átomos foi a necessidade de conciliar as capacidades de transformação da matéria com a noção de permanência do universo. Os átomos4 teriam algumas propriedades imutáveis, tais como tamanho e peso, mas nenhuma estrutura. Haveria espaço vazio (“vácuo”) entre os átomos.
Deve-se enfatizar que não havia qualquer base experimental para estas idéias que, por mais premonitórias que possam ter sido, não passavam de especulações. Por esta razão, elas podiam facilmente ser derrubadas por outras, igualmente arbitrárias. Isto se deu de fato com o domínio da filosofia de Aristote5, que rejeitava a noção de vácuo.
A partir de Aristote e até a Renascência, apenas figuras marginais - e perseguidas pela Igreja Católica, que considerava as idéias de Aristote como dogma cientifíco - especularam sobre átomos. A visão atômica foi reabilitada no século XVI por Gassendi6, que procurou reconciliá-la com o dogma cristão. Talvez não seja mera coincidência que, na mesma época, foram desenvolvidos métodos para criar vácuo, tais como o barômetro de Torricelli e a bomba de ar.
[1] Leucippus, filósofo grego.
[2] Democritus, filósofo grego, -460-370.
[3] Lucretius, poeta e filósofo romano, -97-54.
[4] Do grego "a-tomo", aquilo que não pode ser dividido.
[5] Aristote, filósofo grego, -384-322.
[6] Pierre Gassendi, filósofo e cientista francês, 1592-1655.
Átomos químicos
A transformação da noção filosófica de átomo em conceito científico deve-se em grande parte ao desenvolvimento da química.
Ao serem misturadas, substâncias químicas usualmente formam uma substância que possui propriedades intermediárias em comparação com as das substâncias iniciais. Por exemplo, ao misturar-se açucar com água, em proporções quaisquer, obtem-se água adocicada, na qual as características tanto do açucar como da água estão obviamente presentes. Tal fato sugere fortemente que as espécies químicas, açucar e água, permanecem presentes na mistura. Isto por sua vez seria difícil de conciliar com uma visão contínua da matéria, mas é facilmente entendido numa visão corpuscular, na qual os corpúsculos de água e de açucar convivem na mistura, mantendo a sua individualidade. Substâncias químicas puras são aquelas que não podem ser separadas em componentes por processos físicos tais como centrifugação, evaporação ou distilação. É razoável supor que os corpúsculos que constituem uma substância pura são todos idênticos, pois senão seria possível produzir variedades desta substância. Outra hipótese simplificadora que tem-se revelada correta é que os corpúsculos que constituem uma dada substância pura são os mesmos nos vários estados nos quais a substância pode ser encontrada. Por exemplo, um corpúsculo de água líquida é idêntico a um corpúsculo de vapor de água.
Já numa reação química, as propriedades dos produtos são geralmente muito diferentes das propriedades dos reagentes. Mesmo assim, o estudo das reações químicas tem trazido evidências inconfundíveis da existência de espécies químicas discretas.
Robert Boyle7, na sua obra The Skeptical Chymist (O Químico Cético) foi talvez o primeiro cientista a distinguir entre as substâncias compostas e os elementos que as compõem. Esta distinção foi melhor estabelecida por Lavoisier8 que, em 1774, estabeleceu a lei da conservação das massas dos elementos nas reações químicas. Ele enfatizou a possibilidade de recuperar um elemento na sua forma e quantidade iniciais após combinação com outros de várias maneiras, o que evidenciava a permanência dos corpúsculos que constituem os elementos. Não há transmutação de um elemento para outro.Veja um exemplo.
A lei de formação dos compostos foi durante muito tempo objeto de controvérsia . Ainda no começo do século XIX, o influente químico Berthollet9 acreditava que as proporções de elementos que formiam um composto podiam depender das quantidades inicialmente presentes. Porém, em 1807, Proust10 estabeleceu a lei das proporções constantes, a qual afirma que numa reação química, as razões entre massas de reagentes que se combinam não podem variar de maneira contínua. A partir de reagentes dados, é possível em geral formar mais de um produto, mas para cada um deles,, estas razões são sempre as mesmas, independentemente das quantidades envolvidas e do procedimento utilizado. Experimentos mais elaborados levaram Dalton11 a formular a lei das proporções múltiplas, que podemos enunciar como segue: se considerarmos duas espécies químicas S1 e S2 contendo os elementos A e B, e denotarmos por MA1 e MA2 as massas do elemento A que se combinam nelas com uma dada massa MB do elemento B, então verifica-se que
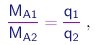 |
(1-1) |
onde q1 e q2 são números inteiros pequenos, independentes de MB. Por exemplo, se considerarmos o monóxido de carbono e o gás carbônico, as massas de oxigênio que se combinam nestas substâncias com uma dada massa de carbono estão na razão 1/2.
Para explicar as suas observações, Dalton formulou um conjunto de hipóteses que constituem o fundamento da teoria atômica e molecular moderna, e que listamos a seguir.
- Os elementos são constituídos de átomos. Todos os átomos de um dado elemento são idênticos; em especial, possuem a mesma massa. Átomos de elementos diferentes possuem massas diferentes.
- Os átomos não podem ser criados nem destruídos, eles apenas sofrem rearrranjo nas reações químicas. Assim fica explicada a lei de Lavoisier.
- Os corpúsculos de uma substância pura composta são moléculas constituídas de átomos dos elementos que a compõem.
Assim, a molécula de uma substância S que contem os elementos A e B será constituída de a átomos de A e átomos b de B. Sendo mA e mB as massas destes átomos, a massa da molécula será
 |
(1-2) |
e para preparar uma quantidade da substância S contendo N moléculas, as massas de A e B necessárias estarão na razão
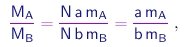 |
(1-3) |
independente de N, conforme exige a lei de Proust.
As massas das moléculas de duas substâncias puras S1 e S1 contendo A e B serão dadas por expressões do tipo (1-2), com coeficientes a1,b1 e a2,b2, respectivamente. Portanto, as massas de A que se combinarão com uma massa de B contendo NB átomos, para formar as substâncias S1 e S2, serão dadas por
 |
e | 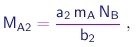 |
(1-4) |
respectivamente. Vê-se que
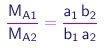 |
(1-5) |
é a razão de dois inteiros. Assim, a lei de Dalton também é satisfeita.
Embora os trabalhos de Dalton constituam-se num grande avanço, eles não permitiram a determinação correta dos números de átomos que compunham as moléculas de todas as espécies químicas conhecidas naquela época. A informação que faltava veio do estudo dos gáses e das suas reações. Na sua forma original, a lei dos gáses de Boyle e Mariotte12 afirma que, a temperatura T fixa, a densidade de massa varia proporcionalmente à pressão. Também foi observado por Gay-Lussac13 e Charles14 que, à pressão p fixa, a densidade varia em proporção inversa da temperatura. Evidentemente, para uma substância pura, a densidade de massa é proporcional à densidade de moléculas n. Portanto, pode-se escrever
 |
(1-6) |
onde k é uma constante que, nesta altura do nosso desenvolvimento, pode depender da substância considerada. Se compararmos dois gáses nas mesmas condições de temperatura e pressão, concluimos que a razão entre as densidades de moléculas,
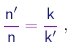 |
(1-7) |
é invariante frente a modificações de pressão ou temperatura.
Ao estudar as reações químicas entre substâncias gasosas, Gay-Lussac estabeleceu em 1808 a lei dos volumes, a qual afirma que as quantidades de substâncias que participam numa reação, quando trazidas para as mesmas condições de temperatura e pressão, ocupam volumes que estão em razões simples. Em especial, se considerarmos a decomposição de uma substância S em duas substâncias S' e S'', os volumes ocupados por elas satisfazem as relações
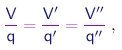 |
(1-8) |
onde q, q', q'' são números inteiros pequenos e independentes da quantidade de substância S considerada. Veja um exemplo.
Para explicitar o significado desta lei na teoria atômica, supomos que as substâncias S e S', mas não a substância S'', contém um dado elemento A. Sejam a e a' os números de átomos de A presentes numa molécula de S e de S', respectivamente. Sejam N e N' os números de moléculas de S e S' envolvidas na reação. Então, pela conservação dos átomos, temos
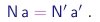 |
(1-9) |
Usando as relações acima, podemos escrever
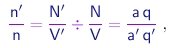 |
(1-10) |
ou seja, a razão entre as densidades de moléculas, além de invariante, deve ser uma fração simples. Generalizando a relação acima a vários compostos contendo o elemento A, podemos escrever
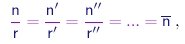 |
(1-11) |
onde r, r', r'' são números inteiros e denotamos por n o valor comum destas razões. Em determinadas condições de temperatura e pressão, a massa de elemento A contida num volume de referência V de um deste compostos será
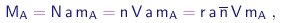 |
(1-12) |
múltiplo do “quantum de massa” n V mA. Ao medirmos estes “quanta” para todos os elementos conhecidos, poderemos determinar as razões entre as massas dos seus átomos. A primeira determinação precisa dos pesos atômicos relativos - de cerca de 40 elementos conhecidos na época – foi realizada por Berzelius15.
O último passo neste desenvolvimento foi dado por Avogadro16 ao enunciar as sua famosa hipótese: a densidade de moléculas em determinadas condições de pressão e temperatura é independente do gás considerado:
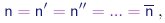 |
(1-13) |
ou ainda, os números inteiros r, r'... introduzidos acima são sempre iguais à unidade e podemos denotar a densidade de moléculas simplesmente por n, independente do gás considerado. Sendo a razão (1-10) sempre igual à unidade, podemos escrever
 |
(1-14) |
ou seja, a medida da razão entre os volumes de gases envolvidos numa reação permite relacionar diretamente os números de átomos contidos nas suas moléculas. Veja um exemplo.
Notamos também que, com a hipótese de Avogadro, a constante k presente na lei dos gáses (1-6) é na verdade uma constante universal, a constante de Boltzmann.
Usando esta hipótese, é possível determinar as razões entre as massas das moléculas de elementos gasosos. Por exemplo: 10 l de H a 0o C e 1 atm tem massa 0,892 g e 10 l de O nas mesmas condições 14,3 g. Daí 14,3 / 0,892 = 16. É curioso que muitos dos erros cometidos por Dalton ao tentar estabelecer as estruturas moleculares originaram-se na suposição que as moléculas dos elementos eram monoatômicas. Com a sua hipótese, Avogadro endireitou a questão, mas passaram-se muitos anos até que a importância desta contribuição seja geralmente reconhecida, principalmente graças aos esforços de Cannizzaro17.
Como discutido acima, os “quanta atômicos” são proporcionais ao número de moléculas que eles contém. Para defini-los completamente, uma convenção é portanto necessária. Seria natural escolher o mais leve dos elementos, hidrogênio, como referência e definir o quantum atômico tal que ele seja igual a 1 g para este elemento. Por razões técnicas, a convenção atualmente adotada é ligeiramente diferente: o quantum atômico, denominado mol, é definido tal que vale exatamente 12 g para o elemento carbono usual18. O valor de correspondente recebe merecidamente o nome de número de Avogadro, que denotaremos por NA. O quantum atômico associado a NA átomos de um elemento é o peso atômico daquele elemento.
Vale notar que, se soubermos o valor de NA, poderemos determinar a massas dos átomos a partir dos valores correspondentes dos pesos atômicos. Vice-versa, se conhecermos o valor da massa do átomo de um elemento, poderemos deduzir do seu peso atômico o valor de NA, e daí calcular as massas de todos os demais átomos a partir dos seus pesos atômicos. Porém, nem a massa de um átomo, nem o número de Avogadro são quantidades fáceis de serem determinadas experimentalmente.
[7] Robert Boyle, químico e físico inglés, 1627-1691.
[8] Antoine Laurent Lavoisier, químico francês, 1749-1794.
[9] Berthollet, químico francês.
[10] Jean Louis Proust, químico francês, 1755-1826.
[11] John Dalton, físico e químico inglés, 1766-1844.
[12] Edme Mariotte, físico francês, -1684.
[13] Joseph Louis Gay-Lussac, físico e químico francês, 1778-1850.
[14] A. C. Charles, físico francês, 1746-1823.
[15] Jöns Jakob Berzelius, químico sueco, 1779-1848.
[16] Amedeu Avogadro, físico e químico italiano, 1776-1856.
[17] Stanislao Cannizzaro, químico italiano, 1826-1910.
[18] Como será discutido adiante neste curso, existem vários isótopos de carbono, átomos com propriedades químicas idênticas porém massas diferentes.
Teoria cinética dos gases
Uma vez aceito que a matéria é composta de átomos e moléculas, tem-se um novo ponto de partida na tarefa de explicar as suas propriedades. É natural começar pelo estudo do estado gasoso, no qual as moléculas estão muito distantes uma da outra a maior parte do tempo. Neste caso pode-se esperar que o conhecimento detalhado das interações entre moléculas não seja necessário para se obter uma descrição adequada.
Se concerbermos um gás como um conjunto de moléculas livres, apenas confinadas pelas paredes do recipiente que as contém, poderemos explicar a pressão aplicada pelo gás sobre uma parede como resultante das colisões com esta das moléculas dos gás. É conveniente supor que o recipente seja um cubo de lado L.
Na colisão de uma molécula de massa m com uma parede perpendicular ao eixo x, a componente px = m vx do momentum linear trocará de sinal. Pela conservação do momentum, uma quantidade de momentum
 |
(1-15) |
será transferida à parede. O intervalo entre colisões sucessivas desta molécula com esta parede será Dt = 2 L / vx e portanto a taxa de transferência de momentum, ou ainda, a força aplicada pela molécula sobre a parede será
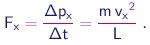 |
(1-16) |
Para obter a pressão sobre a parede basta multiplicar este resultado pelo número N de moléculas no recipiente, dividir pela área L2 da face do cubo e tomar a média, pois a velocidade pode variar de uma molécula para outra. Assim obtemos
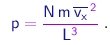 |
(1-17) |
Como as três direções são equivalentes, temos obviamente vx2 = vy2 = vz2 = v2 / 3 e chegamos ao resultado
 |
(1-18) |
onde introduzimos a densidade de massa r = N m / L3 = M / V.
A energia cinética média por molécula é
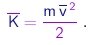 |
(1-19) |
Portanto, já que estamos desprezando as energias potenciais de interação entre moléculas, a densidade de energia é dada por
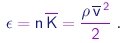 |
(1-20) |
Concluimos que a teoria cinética dos gáses prevê a simples relação
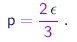 |
(1-21) |
Utilizando agora a lei dos gáses (1-5), podemos re-escrever esta relação na forma
 |
(1-22) |
ou
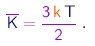 |
(1-23) |
Assim, a energia cinética média por molécula dos gás depende apenas da temperatura. Em especial, é independente da massa das moléculas. Temos aqui um exemplo de um fato mais geral, conhecido como princípio de equipartição da energia, que afirma que, num sistema em equilíbrio térmico à temperatura , a energia cinética média associada a cada grau de liberdade vale kT/2. No caso de moléculas em movimento de translação no espaço tridimensional, são evidentemente três os graus de liberdade. Faremos uso deste princípio em outro contexto mais adiante.
Dimensões atômicas e número de Avogadro
As massas e os tamanhos atômicos e moleculares, assim como os números destes corpúsculos presentes num dado volume, são as quantidades que caracterizam a descrição corpuscular da matéria. Evidentemente, elas estão relacionadas por observações feitas a nível “macroscópico”. Por exemplo, no estado condensado (líquido ou sólido) se soubermos quantas moléculas há num determinado volume, poderemos determinar o seu tamanho e, a partir da densidade do matérial, a massa de cada molécula. Assim, é de fundamental importância a determinação de uma destas grandezas, por exemplo o número de moléculas num mol.
A teoria cinética dos gáses fundamentou a primeira determinação experimental do número de Avogadro, realizada em 1865 por Loschmidt19, que se valeu de resultados teóricos obtidos por Maxwell20 e Clausius21.
As moléculas de um gás são livres apenas em primeira aproximação. Mesmo num gás bastante diluído, uma molécula ocasionalmente encontra uma outra molécula e sofre colisão. O livre caminho médio l é a distância média percorrida por uma molécula entre colisões.
Colisões são também responsáveis pelo fato que uma camada de gás em movimento em relação a outra irá arrastar esta no seu movimento. Este é o fenômeno de viscosidade. O coeficiente de viscosidade h é definido como a força tangencial exercida por uma camada sobre uma superfície unitária da camada vizinha quando existe um gradiente de velocidade unitário, perpendicular ao fluxo de gás. Argumentaremos que o coeficiente de viscosidade é proporcional ao produto de três fatores:
- a densidade r do gás. Isto é natural já que quanto mais massivas e mais numérosas (por unidade de volume) as moléculas, maior será o efeito do seu impacto com as moléculas da camada vizinha.
- a velocidade média v das moléculas. Isto também é facilmente entendido, já que o momentum das moléculas determina a intensidade do impacto.
- o livre caminho médio l das moléculas. Talvez isto seja menos intuitivo, mas um pouco de reflexão nós faze entender que, quanto maio for, mais distante da camada impactada será a camada da qual a molécula originou-se. Portanto, em razão do gradiente transversal no fluxo do gás, maior será a diferença de velocidade entre as moléculas que sofrem a colisão, e maior será o efeito da mesma.
Um cálculo detalhado leva ao resultado
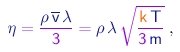 |
(1-24) |
onde usamos as relações (1-19) e (1-23) para expressar a velocidade média das moléculas em termos da massa das mesmas e da temperatura do gás.
Temos até aqui duas quantidades incognitas ( l e m ) e precisamos obter uma outra relação. Imaginamos as moléculas como esferas de diâmetro D que colidem como bolas de gude, e focamos o movimento de uma delas, considerando em primeira aproximação as outras como fixas no espaço. Supomos que a molécula considerada acaba de sofrer uma colisão. Para ser a próxima atingida, uma molécula deve ter o seu centro a uma distância máxima D da linha de movimento da molécula considerada. Portanto, deve encontrar-se dentro de um cilindro cujo eixo coincide com a linha de movimento da molécula focada, cujo raio é D e cujo comprimento é l, já que esta é a distância percorrida entre colisões. Ou seja, o volume p D2l deste cilindro deve conter na média uma molécula. Levando-se em conta o movimento das moléculas, mostra-se que este volume deve ser multiplicado por 21/2 , de maneira que a relação correta é
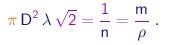 |
(1-25) |
Utilizando o resultado acima para eliminar o produto l r da expressão (1-24), obtemos
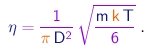 |
(1-26) |
É interessante notar que a viscosidade de um gás revela-se independente da pressão neste modelo, dependendo apenas da temperatura. Este resultado um tanto surpreendente foi verificado em experimentos realizados pelo próprio Maxwell. Já que podemos medir a viscosidade, a equação acima estabelece uma relação entre a massa de uma molécula e o seu diâmetro:
 |
(1-27) |
Para obtermos uma outra relação entre estas quantidades, consideremos agora o estado condensado, no qual vamos supor que as as moléculas "se tocam", ocupando o menor volume possível. Sendo rcond o valor (facilmente medido) da densidade neste estado, podemos escrever
 |
(1-28) |
O fator 4 / 3 foi introduzido para levar em conta, em boa aproximação, o espaço vazio entre moléculas, consideradas como bolas numa pilha. Pode-se mostrar que, nume pilha de bolas, cada bola ocupa um volume igual a aproximadamente 4/3 do seu próprio volume. De (1-27) e (1-28), tiramos uma estimativa para o diâmetro da molécula:
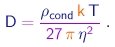 |
(1-29) |
Para poder aplicar este resultado, devemos utilizar uma substância cuja viscosidade no estado gasoso possa ser medida, e que possa ser trazida para o estado sólido ou líquido. Veja um exemplo.
Obviamente, devido às simplificaões feitas, não podemos esperar obter um valor preciso com este procedimento. Átomos e moléculas certamente não são esféras rígidas, e não necessariamente estão "empilhadas" da maneira mais eficiente no estado condensado. Apesar disto, a ordem de grandeza do raio atômico é corretamente estimada (veja o exemplo):
| Rátomo ~ 10-10 m = 1 Å . | (1-30) |
Encontraremos algumas outras maneiras de determinar o número de Avogadro no decorrer dos nossos estudos. Mencionamos aqui o movimento Browniano, que vem a ser o movimento aleatório realizado por uma parcela de matéria, pequena mas observável com a ajuda de um microscópio, imersa num líquido. Este efeito devido aos impactos sobre a parcela das moléculas do líquido em agitação térmica foi descoberto em 1827 por Brown22, analizado teoricamente por Einstein23 e estudado experimentalmente principalmente por Perrin24.
O valor atualmente aceito para o número de Avogadro é
| NA = 6,02 1023 . | (1-31) |
[19] Josef Loschmidt, físico tcheco, 1821-1895.
[20] James Clerck Maxwell, físico escocês, 1831-1879.
[21] Rudolf Julius Emanuel Clausius, físico alemão, 1822-1888.
[22] Robert Brown, botânico escocès, 1773-1858.
[23] Albert Einstein, físico alemão, 1879-1955.
[24] Jean Perrin, físico francês, 1870-1942.
Surgimento da Física Moderna
Lei de Faraday para a eletrólise (1833)
É sabido que a dissolução de sal de cozinha na água aumenta consideravelmente a condutividade elétrica da mesma. A interpretação deste fenômeno é que as moléculas NaCl do sal em solução sofrem uma dissociação em sódio Na e cloro Cl, porém com os átomos destes elementos carregados eletricamente, ou seja na forma de íons. Já que a solução é globalmente neutra, os íons de Na e Cl devem possuir cargas iguais e opostas.
Uma eletrólise é realizada com a imersão na solução de dois eletrodos, um positivo (o anodo) e outro negativo (o catodo). Observa-se a passagem de uma corrente pela solução e a acumulação de cloro próximo ao anodo e de sódio próximo ao catodo. Já que cargas opostas se atraem, conclui-se que os íons de cloro estão carregados negativamente e os íons de sódio estão carregados positivamente.
Ao estudar-se a relação entre a quantidade de eletricidade que atravessa o dispositivo de eletrólise e as quantidades de matéria recolhidas nos eletrodos, observa-se que para se obter um mol de sódio (23 g) no catodo, a quantidade de eletricidade necessária é sempre a mesma e vale
| 96.500 C = 1 F, | (1-1) |
denominada faraday (F) em homenagem ao descobridor1 desta lei. Como é de se esperar, recolhe-se então um mol de cloro (35,5 g) no anodo. Isto indica que os íons Na+ e Cl- sempre possuem as mesmas cargas, que denotamos por +e e -e, respectivamente.
Como um mol de qualquer substância sempre contem o mesmo número de átomos, qual seja o número de Avogadro NA, tem-se a relação
| F = NA e. | (1-2) |
Se substituirmos o sal de cozinha por clorúrio de cobre CuCl2, verificamos que precisamos de uma quantidade de eletricidade igual a 2 F para acumular um mol de cobre (63,5 g) no catodo e obtemos então dois mols de cloro no anodo. Devemos portanto atribuir a carga +2e ao íon de cobre, que denotamos Cu++. Íons como Na+ e Cl- são chamados monovalentes, ao passo que Cu++ é bivalente. Íons trivalentes, etc, também são encontrados, mas nunca íons cuja carga não seja um múltiplo inteiro de e, que pode ser considerado então como o quantum elementar de carga.
O valor de e pode ser deduzido da relação (1-2) desde que o valor de NA seja conhecido. Com o valor atual
| NA = 6,02 1023 partículas/mol, | (1-3) |
obtem-se
| e = 1,602 10-19 C. | (1-4) |
Em 1874, Stoney2 sugeriu o nome elétron para a quantidade elementar de carga e. Após a descoberta dos raios catódicos [veja adiante], o mesmo nome foi atribuido às particulas que constituem estes raios, e cuja carga é de fato igual a -e.
[1] Michael Faraday, físico e químico inglês, 1791-1867.
[2] George Johnstone Stoney, físico irlandês, 1826-1911.
Raios catódicos - Medidas de e/m
As descargas elétricas num gás foram objetos de vários estudos no decorrer do século XIX. No caso de gás contido num tubo de vidro, ao diminuir-se a pressão foi observada a aparição de fluorescência nas paredes da tubo próximas a um catodo metálico aquecido. Verificou-se que um objeto colocado entre o catodo e a parede projeta uma “sombra” nesta fuorescência, o que sugeria que o efeito devia-se à propagação até a parede de raios oriundos do catodo. Estavam descobertos os raios catódicos.
Algumas propriedades destes raios foram logo observadas:
- São capazes de atravessar, sem produzir estragos, películas de vidro ou metal de alguns mícrons de espessura.
- São capazes de aquecer consideravelmente um material.
- Podem ser desviados por um campo eletromagnético.
Ao recolher raios catódicos num eletrômetro, Perrin em 1895 determinou que possuiam carga elétrica negativa. Assim, a possibilidade de os raios serem um fenômeno ondulatório análogo à luz foi descartada e eles passaram a ser considerados como formados de partículas. O principal desafio era então de determinar a massa m e a carga e destas partículas.
Utilizamos a notação e para a carga destas partículas, antecipando o fato de que ela iria revelar-se igual à carga do elétron. Porém, na época, isto não era estabelecido; aliás, nem se sabia se esta carga era a mesma para todos os raios catódicos. Semelhantemente, usamos a notação m para a massa das partículas em questão, massa esta que revelará-se também possuir o mesmo valor para todos os raios catódicos.
Para pequenas partículas percorrendo uma distância curta em altissima velocidade, como é o caso dos raios catódicos num tubo, o desvio produzido pela força peso é absolutamente desprezível. Sendo as partículas carregadas, pode-se obter informação sobre elas pela aplicação de campos eletromagéticos. Porém, é fácil ver que, tal procedimento permitirá determinar apenas a razão entre carga e massa, nunca os valores separados destas grandezas. De fato a segunda lei de Newton com a força de Lorentz formece
 |
para a aceleração de uma partícula, de maneira que o movimento da partículas no campo dependerá apenas das condições iniciais e da razão e/m.
Para medir esta razão, J. J. Thomson3 realizou em 1897 dois experimentos distintos.
- No primeiro experimento, os raios catódicos atravessavam um campo magnético uniforme B, de valor conhecido, perpendicular à sua direção de movimento. Como é sabido, nestas condições, a trajetória das partículas é circular e o seu raio R pode ser obtido igualando a força centrípeta à força magnética:
onde v é a velocidade da partícula.
(1-5)
Além do raio da trajetória, Thomson mediu com um eletrômetro a carga total Q das partículas, e com um calorímetro a sua energia cinética total K. Se N for o número de partículas, devemos ter evidentemente: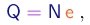
(1-6)
Eliminando-se v e N das três equações acima, obtem-se facilmente
(1-7) 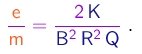
(1-8) - O segundo experimento consistia em duas operações.
- Primeiramente, aplicava-se aos raios catódicos campos elétrico E e magnético B "cruzados", quer dizer, perpendiculares entre si e perpendiculares à direção do feixe. Os valores dos campos eram ajustados de tal maneira que os raios não sofressem nenhum desvio, ou seja, de maneira tal que a força elétrica fosse equilibrada pela força magnética. A condição para tanto é
Assim, a medição dos campos E e B que realizam esta condição permite a determinação da velocidade do feixe,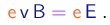
(1-9) 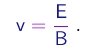
(1-10)
- A seguir, o campo magnético era desligado. Como atuava apenas o campo elétrico E na direção transversal Oy (na região entre as placas, de comprimento L), a velocidade vx na direção longitudinal era igual a v, dada por (1-10):
As particulas atravessavam a região entre as placas no tempo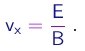
(1-11)
Durante este intervalo de tempo, elas eram sujeitas à aceleração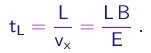
(1-12)
Portanto, elas sofriam o desvio transversal
(1-13)
Ao sair da região onde atua o campo elétrico, as particulas possuiam a velocidade transversal
(1-14) 
(1-15)
Elas demoravam o tempo
até chegar à tela, em movimento retilíneo uniforme. Portanto, durante esta segunda parte do percurso, elas sofriam o deslocamento transversal adicional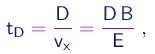
(1-16)
Somando (1-14) e (1-17), obtem-se o deslocamento transversal total do feixe: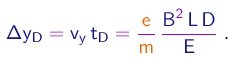
(1-17)
Vê-se que, uma vez medidos os campos E e B, e sabendo-se as dimensões L e D características do tubo, é possível deduzir a razão e/m pela determinação do desvio Dy do feixe sobre a tela.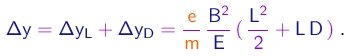
(1-18)
- Primeiramente, aplicava-se aos raios catódicos campos elétrico E e magnético B "cruzados", quer dizer, perpendiculares entre si e perpendiculares à direção do feixe. Os valores dos campos eram ajustados de tal maneira que os raios não sofressem nenhum desvio, ou seja, de maneira tal que a força elétrica fosse equilibrada pela força magnética. A condição para tanto é
- O experimento de Thomson e outros semelhantes, realizados com vários tipos de tubo, com catodos feitos de diferentes metais, fornecem sempre o mesmo valor, dentro das incertezas experimentais. O valor atualmente aceito é
Caso se verificasse - como de fato se verificou - que a carga das partículas é realmente igual à carga elementar (1-4) extraída da eletrólise, teriamos para a massa das partículas: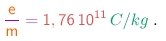
(1-19)
A título de comparação, a massa do mais leve dos átomos (o átomo de hidrogênio) é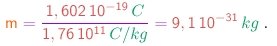
(1-19b)
Vê-se que, uma vez Assim, as partículas dos raios catódicos seriam cerca de 1835 vezes mais leves ainda! Porém, até este ponto, não podemos descartar a possibilidade que as partículas tenham massa comparável em grandeza com a massa atômica, mas neste caso elas teriam que possuir uma carga muito maior que a carga elementar.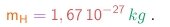
[3] Joseph John Thomson, físico inglês, 1856-1940.
Medida de e - Experimento de Millikan (1909)
Como discutido acima, para determinar separadamente a carga e a massa de uma partícula, é necessário utilizar outras forças, além da força eletromagnética. A força peso e as forças "macroscópicas", em especial a força de arraste no ar, são candidatas óbvias, mas torna-se então necessário estudar objetos bem maiores que as partículas dos raios catódicos. Nos seus clássicos experimentos, Millikan4 utilizou gotinhas de óleo e outros líquidos.
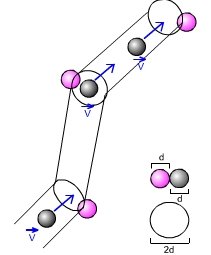
- O experimento procura determinar o valor da carga elementar e através do estudo do movimento de pequenas gotas carregadas sob a ação combinada da gravitação, do arraste do ar e de um campo elétrico vertical.
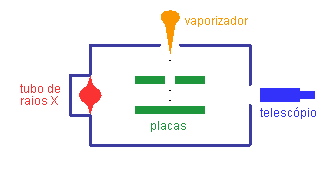
Esquema do experimento de Millikan
Veja o diagrama do experimento apresentado no artigo de Millikan.
- Sendo muito pequenas, as gotas possuam uma velocidade terminal muito pequena e a alcançam muito rapidamente. Nestas condições, a força de arraste pode ser considerada, em boa aproximação, como proporcional à velocidade:
onde o coefficiente b é proporcional à viscosidade h do ar e depende da geometria da gota. Para uma gota esférica de raio r, b é dado pela lei de Stokes: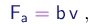
(1-20) 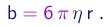
(1-21)
- Eliminando b entre (1-23) e (1-26), pode-se escrever
Observa-se a gota descendo uma distância L na ausência de campo elétrico e depois subindo a mesma distância L na presença do campo. Sendo Td e Ts respectivamente os tempos de descida e de subida, temos obviamente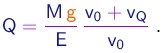
(1-27)
e podemos re-escrever (1-27) na forma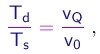
(1-28) 
(1-29)
- No experimento de Millikan, a mesma gota era observada descendo e subindo várias vezes, sempre com o campo elétrico desligado nas descidas e ligado ao mesmo valor nas subidas. Entre subidas, a gota era irradiada por raios X, de maneira a modificar a sua carga elétrica. Se a carga muda do valor Q para o valor Q', a única quantidade que muda no lado direito da equação (1-29) é o tempo de subida e temos
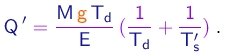
(1-30)
- Se a carga for um múltiplo inteiro da carga elementar e,
a equação (1-29) poderá ser re-escrita na forma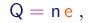
(1-31)
Com a mesma hipótese, a mudança na carga entre subidas sucessivas será da forma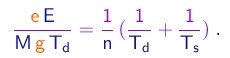
(1-32)
e a diferença entre as equações (1-30) e (1-29) tomará a forma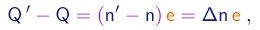
(1-33)
Comparando as equações (1-32) e (1-34), obtem-se a condição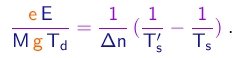
(1-34)
Tendo medido Td, Ts e Ts', a tarefa é achar números inteiros n e Dn tais que esta igualdade seja satisfeita. Denotamos por C o valor comum dos dois lados da igualdade.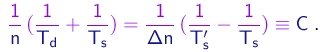
(1-35)
- Se conseguirmos determinar o valor da massa M da gota, poderemos finalmente determinar o valor da carga elementar através de
Sendo r a densidade do líquido utilizado, a massa de uma gota é dada em termos do seu raio por
(1-36)
Para determinar o raio, utilizamos a fórmula de Stokes. De (1-23), (1-37) e (1-21), obtemos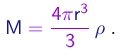
(1-37)
que permite calcular o raio da gota em termos de quantidades conhecidas ou medidas no experimento: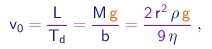
(1-38)
A massa da gota segue então da expressão (1-37).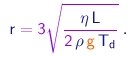
(1-39)
- Veja um exemplo numérico.
Veja uma simulação do experimento de Millikan.
[4] Robert Andrews Millikan, físico americano, 1868-1953.
Surgimento da Física Moderna
Propriedades gerais do átomo
Discutimos anteriormente a primeira determinação do número de Avogadro, baseada na teoria cinética dos gases. Vimos que esta determinação passa pela estimativa do tamanho do átomo. No exemplo numérico, foi obtido um valor da ordem de 10-10 m, que podemos adotar como escala típica das dimensões atômicas e moleculares.
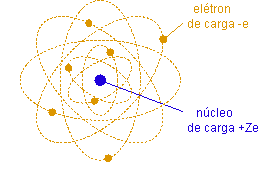
Uma vez estabelecido que a matéria é capaz de emitir elétrons, partículas aparentemente puntuais, de carga negativa e de massa muito pequena em comparação com a massa de um átomo, é natural supor que o átomo é composto de um certo número de elétrons e de cargas positivas, de maneira a ser globalmente neutro. A maior parte da massa do átomo deve ser concentrada nas cargas positivas. O tamanho do átomo deve ser da ordem de 10-10m.
De acordo com a teoria clássica, um campo eletromagnético oscilante induzirá num sistema de cargas, oscilações de freqüência igual à do campo. Se a freqüência do campo for igual a uma freqüência própria de oscilação do sistema, a transferência de energia do campo para o sistema de cargas será particularmente eficiente. Semelhantemente, um sistema de cargas excitado emitirá radiação nas suas freqüências de oscilação. Assim, um modelo do âtomo deveria levar a freqüências de oscilação das cargas nele contidas cujos valores correspondam às linhas de absorção e emissão de radiação pelo elemento em questão.
Modelo de Thomson
Dadas as características acima, a principal hipótese necessária na construção de um modelo atômico diz respeito à distribuição das cargas positivas. J. J. Thomson supús que esta distribuição é contínua e extensa ao tamanho do átomo. Os elétrons seriam cargas negativas puntuais distribuídas neste contínuo de cargas positivas como "passas num pudim".
Era então necessário procurar configurações estáveis dos elétrons no contínuo positivo, e determinar as freqüências próprias de oscilação do sistema em torno destas configurações. Os esforços de Thomson no desenvolvimento deste programa não o levaram a resultados animadores.
Espalhamento de partículas a
Em 1896, Henri Becquerel1 notou manchas sobre placas fotográficas que tinham sido guardadas numa gaveta junto com um pedaço de urânio. Ele tinha assim descoberto - por acaso - a radioatividade. Pouco tempo depois Pierre2 e Marie Curie3 observaram radioatividade produzida por outros elementos, em especial tório, polônio e rádio.
Ao estudar a absorçaõ pela matéria da radiação emitida pelo urânio, Rutherford4 estabeleceu que ela era composta de dois tipos de raios, que ele denominou raios a e raios b. Rutherford então realizou estudos mais detalhados dos raios a, mostrando que eles são constituídos de partículas carregadas positivamente. Recolhendo uma quantia destas partículas num container evacuado, no qual elas neutralizavam-se, e comprimindo o gás rarefato resultante, pude verificar que este gás apresentava o espectro característico do hélio. Por um procedimento semelhante àquele utilizado por Thomson para os raios catódicos, determinou o valor da razão qa / ma. Sabendo o valor da massa (essencialmente igual à do átomo de hélio, ma = 4 mH ), estabeleceu que qa = + 2 e.
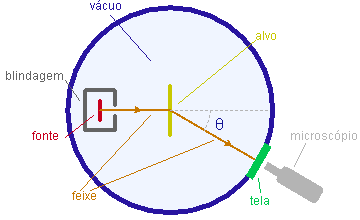
Ao realizar estes estudos, Rutherford notou que o ar remanescente na região atravessada pelas partículas produzia algum espalhamento destas. Já que os elétrons são muito mais leves que as partículas a, eles dificilmente podiam ser responsáveis por este efeito. Portanto, Rutherford raciocinou que o estudo sistemático do espalhamento de partículas a poderia fornecer informação valiosa sobre a distribuição da carga positiva no átomo.
O esquema básico do experimento está representado na figura. Uma fonte raioativa natural emite partículas a que são colimatadas para formar um feixe que se propaga numa câmara evecuada, colidindo com um alvo constituído de uma folha fina de metal. As partículas espalhadas na direção especificada pelo ângulo de espalhamento q são contadas atravês da observação, com um microscópio, das fluorescência que produzem sobre uma tela de sulfeto de zinco.
Na base do modelo de Thomson, apenas espalhamentos em pequenos ângulos eram esperados já que, ao penetrar o átomo, a partícula mergulharia suavemente na distribuição contínua de carga, não sofrendo ação violenta. Veja uma animação.
Modelo de Rutherford
Porém, Rutherford observou um número significativo de espalhamentos por grandes ângulos, chegando ocasionalmente a partícula a a "voltar para trás", ou seja, a ser espalhada em ângulos superiores a noventa graus. Para que isto possa acontecer, era necessário que haja dentro do átomo um corpo pesado localizado, capaz de transmitir um forte impulso à partícula.
Rutherford estava sendo levado pelos seus dados a propor o modelo nuclear da átomo, que podemos resumir na afirmação: a carga positiva +Ze está concentrada numa região de tamanho muito menor que o tamanho do átomo, o núcleo do átomo. O núcleo carrega a quase totalidade da massa do átomo, mas o tamanho do átomo é determinado pelo volume ocupado pelos elétrons em movimento orbital ao redor do núcleo.
Se o alvo for constituído de um elemento de peso atômico suficientemente alto, uma particula a, ao penetrar profundamente nesta "nuvem eletrônica" e aproximar-se suficientemente do nácleo, sente uma força repulsiva intensa aplicada por um centro de força bem mais pesado que ela e sofre um desvio considerável.
Nestas condições, podemos em boa aproximação desprezar as força aplicadas pelos elétrons sobre a particula a e considerar o núcleo alvo como um centro de força fixo. A força aplicada pelo núcleo sobre a particula é radial e repulsiva, com módulo dado por
 |
(4-1) |
onde r é a distância partícula-núcleo e
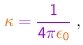 |
(4-2) |
sendo e0 a constante dielétrica do vácuo.
A força (4-1) é conservativa e a energia potencial associada é
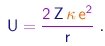 |
(4-3) |
A energia mecânica total é conservada e dada por
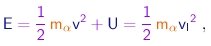 |
(4-4) |
onde vI é a velocidade inicial das partículas, ou seja, antes de elas penetrarem no alvo.
Além desta velocidade, a outra quantidade que pode ser utilizada convenientemente para especificar o estado inicial é o parâmetro de impacto b, que vem a ser a distância entre a linha de movimento inicial da partícula e a linha paralela passando pelo centro de força, ou seja, pelo núcleo do alvo. Vale notar que o momentum angular, que também é conservado já que a força é central, é dado por
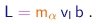 |
(4-5) |
A resolução detalhada do problema mostra que a trajetória da partícula é uma hiperbola e estabelece a relação entre o parâmetro de impacto e o ângulo de espalhamento:
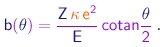 |
(4-6) |
Vê-se que o ângulo de espalhamento aumenta quando o parâmetro de impacto diminui. Portanto, as partículas espalhadas em ângulos superiores a um dado valor q são aquelas que chegam com parâmetro de impacto inferior a b, dado pela relação (4-6), ou ainda, aquelas cujas linhas de movimento inicial estão contidas num cilindro de seção pb2. Denotaremos por I a intensidade do feixe, ou seja, o número de partículas incidentes por unidade de área e tempo. Denotaremos por N1(>q) o número de partículas espalhadas em ângulos maiores que q, por unidade de tempo e por partícula do alvo. Temos então
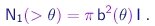 |
(4-7) |
Supomos que o alvo é constituído de um único tipo de átomos e denotamos por n o número destes átomos por unidade de volume. Evidentemente, apenas aqueles núcleos que estiverem no caminho do feixe poderão contribuir para o espalhamento. Sendo d a espessura do alvo e S a seção transversal do feixe, haverá n d S tais núcleos espalhadores e o número total de partículas a espalhadas em ângulos maiores que q, por unidade de tempo será
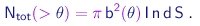 |
(4-8) |
Do outro lado, o número de partíclas incidentes, por unidade de tempo, é obviamente
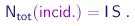 |
(4-9) |
Portanto, a fração de partículas espalhadas em ângulos maiores que q é dada por
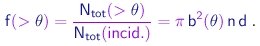 |
(4-10) |
Além da sua variação com o ângulo de espalhamento, fica claro das expressões (4-10) e (4-6) que a quantidade relativa de partículas espalhadas deve possuir as seguintes características, se a teoria estiver correta:
- deve depender da energia E da fonte radioativa, sendo proporcional a E-2, ou seja, a vI-4;
- deve depender do número atômico Z do alvo, sendo proporcional a Z2;
- deve ser proporcional à espessura d do alvo.
Experimentos detalhados realizados por Geiger5 e Marsden6, colaboradores de Rutherford, confirmaram estas previsões. Vale notar que a análise acima supõe que cada partícula a é espalhada no máximo por um núcleo apenas. Isto sera válido apenas para alvos suficientemente finos. Para alvos mais espessos, correções devidas a espalhamentos múltiplos devem ser levadas em conta.
Tamanho do núcleo atômico
A análise acima supõe que o núcleo pode ser considerado como uma carga pontual, cuja única interação com a partícula a é aquela descrita pela lei de Coulomb. Se a carga positiva contida no átomo estiver na verdade distribuída numa certa região do espaço, e se a partícula a for capaz de penetrar naquela região, desvios entre as predições da teoria e os dados experimentais deverão ser observados. Isto também acontecerá caso outras forças, até aí desconhecidas, entrarem em jogo.
A repulsão eletrostática entre o núcleo e a partícula a mantem esta a uma certa distância mínima rmin do centro do núcleo. Mais especificamente, para uma dada energia total E, a partícula está proibida de penetrar na região na qual a energia potencial U se torna maior que E. A maior aproximação é alcançada quando
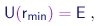 |
(4-11) |
ou seja, quando a partícula para e a sua energia cinética se anula. Fica claro que isto só pode ocorrer numa colisão frontal, caracterizada por b = 0 e q = 180o.
Utilizando a forma (4-3) da energia potencial e resolvendo a equação (4-11), obtemos
 |
(4-12) |
Como era de se esperar, para uma dada energia, quanto maior for a carga do núcleo, maior será a distância mínima alcançada pela partícula a. Por esta razão, com as fontes disponíveis na época, não foi possível estabelecer o tamanho dos núcleos dos elementos de grande número atômico - ouro, por exemplo tem Z = 79 - que foram utilizados nos primeiros experimentos. Porém, ao estudar o espalhamento em grandes ângulos por um alvo de número atômico bem menor - alúminio, que tem Z = 13 - foi possível observar desvios dos dados em relação à teoria e estabelecer que a ordem de grandeza do tamanho do núcleo é 10-15 a 10-14 metros. Veja um exemplo.
[1] Antoine Henri Becquerel, físico francês, 1852-1908.
[2] Pierre Curie, físico francês, 1859-1906.
[3] Marie Curie, física polonesa, 1867-1934.
[4] Ernest Rutherford, físico neozelandês, 1871-1937.
[5] Hans Geiger, físico alemão, 1882-1947.
[6] Ernest Marsden, físico britânico, 1889-1970.
Surgimento da Física Moderna
Emissão e absorção - Espectros de linhas
- Materiais podem emitir e absorver radiação eletromagnética. Para um dado material em determinadas condições (estado gazoso ou condensado, temperatura, etc), a intensidade de radiação emitida ou absorvida varia com o comprimento de onda l da radiação. Referimo-nos a esta variação como constituindo o espectro de emissão ou absorção do material.
- Um espectro é em geral constituído de várias partes que possuem origens físicas diversas. Mais adiante, discutiremos a parte contínua do espectro associada à agitação térmica dos corpúsculos do material. Nesta seção dirigimos a nossa atenção para a parte discreta do espectro, constituída de linhas de emissão ou absorção que correspondem a valores bem definidos de l. Estas linhas são caracteristicas dos átomos do material e o seu estudo fornece informações valiosas sobre a estrutura destes átomos.
- Uma propriedade importante é que o espectro de linhas de absorção de um dado material é idêntico ao seu espectros de linhas de emissão.
Espectro do átomo de hidrogênio
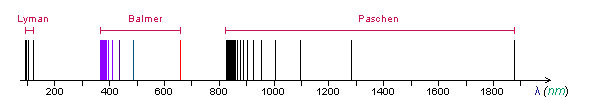
- Os espectros de linhas dos elementos foram estudados sistematicamente a partir dos últimas décadas do século XIX. Foi verificado que as linhas tendem a se agrupar em séries. As linhas numa dada série tendem a se aproximar cada vez mais quando o comprimento de onda diminui, tendendo para uma determinado valor llim chamado limite da série.
- No caso do hidrogênio - o mais leve dos elementos, portanto presumivelmente o mais simples dos átomos - uma primeira série foi identificada na parte visível do espectro em 1885 por Balmer. Subsequentemente, outras séries foram identificadas, uma no ultravioleta por Lyman e outra no infravermelho por Paschen. Estas três séries estão representadas na figura abaixo (as linhas que estão fora da região visível de espectro estão representadas na cor negra).
- Uma fórmula empírica que descreve com precisão estas séries foi estabelecida por Rydberg e por Ritz. Nela, uma linha é especificada por dois números inteiros. O primeiro m, que pode tomar os valores m=1, m=2, m=3... especifica a series à qual a linha pertence. O segundo n, que pode tomar os valores n=m+1, n=m+2, n=m+3... especifica uma linha dentro da séries. O comprimento de onda da linha (m, n) é dado por
onde a constante de Rydberg tem a valor empírico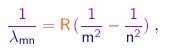
(3-1)
Como a fórmula (3-1) dá o inverso do comprimento de onda, vê-se que qualquer comprimento de onda será dado por uma fração racional multiplicando o inverso da constante de Rydberg, cujo valor é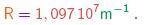
(3-2) 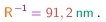
(3-3) - Por exemplo, a primeira linha da série de Balmer corresponde a m=2 e n=3 e possui comprimento de onda igual a
O limite desta série é obtido ao fazer n tender para o infinito e vale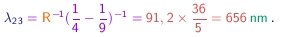
Para a série de Lyman, os valores correspondentes são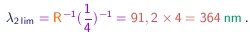
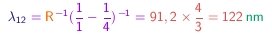
e